题目内容
【题目】实验测定H2C2O4·xH2O 中x值: 已知:M(H2C2O4)=90 g·mol-1
①称取 1.260 g H2C2O4·xH2O晶体,将其配成100.00 mL 水溶液为待测液;
②量取 25.00mL 待测液放入锥形瓶中,再加入适量的稀H2SO4;
③用20.00ml浓度为 0.05000 mol·L-1的 KMnO4标准溶液进行滴定。
(提示:H2C2O4被氧化为CO2 , KMnO4被还原为MnSO4)
(1)请写出与滴定有关反应的化学方程式______________。
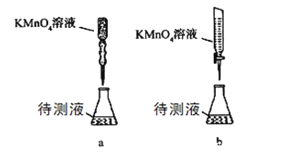
(2)某学生的滴定方式(夹持部分略去)如下,最合理的是_____(选填 a、b)。
(3)滴定过程中眼睛应注视______________________。
(4)通过上述数据,求得x=____________。以标准KMnO4溶液滴定样品溶液的浓度,未用标准KMnO4溶液润洗滴定管,引起实验结果______(偏大、偏小或没有影响)。
【答案】5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+8H2O+K2SO4 b 锥形瓶中颜色变化 2 偏小
【解析】
根据氧化还原反应原理5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+8H2O+K2SO4进行分析判断。根据高锰酸钾溶液具有强氧化性选择酸式滴定管;根据滴定主意事项进行判断。
(1)高锰酸钾把草酸氧化为二氧化碳,自身被还原为硫酸锰,根据电子得失守恒和原子守恒可知发生反应的化学方程式为5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+8H2O+K2SO4;
(2)酸性高锰酸钾溶液具有强氧化性,不能用碱式滴定管盛放,只能选择酸式滴定管盛放,故选b装置;
(3)滴定过程中眼睛应注视锥形瓶中颜色变化,当滴最后一滴KMnO4,溶液由无色变为紫红色,且半分钟不褪色,说明达到滴定终点;答案:锥形瓶中颜色变化。
(4)由5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+8H2O+K2SO4知5H2C2O4~2KMnO4,c(H2C2O4)=(20.00mL×0.05000 mol·L-1×5)/2×25mL=0.1 mol·L-1,n(H2C2O4)=0.1 mol·L-1×0.1L=0.01mol,所以n(H2O)=(1.260g-0.01mol×90 g·mol-1)/18 g·mol-1=0.02mol。0.01mol H2C2O4中含有0.02molH2O,所以x=2;以标准KMnO4溶液滴定样品溶液的浓度,未用标准KMnO4溶液润洗滴定管,导致KMnO4溶液浓度较低,消耗标准KMnO4溶液的体积偏大,引起实验结果偏小。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】设Na为阿伏加德罗常数的值。已知反应:
①CH4 (g) +2O2 (g) = CO2 (g) +2H2O(l) △H1 =a kJ mol -1
②CH4(g) + 2O2 (g) = CO2 (g) +2H2O(g) △H2 =bkJ mol-1
键能定义:在标准状况下,将1 mol气态分子AB(g)解离为气态原子
A(g)、B(g)所需的能量。已知1 mol氧气的键能为xkJ。其他数据如下 表所示,下列说法正确的是
化学键 | C—O | C—H | O—H |
键能/(kJ mol-1) | 798 | 413 | 463 |
A.上文中x=![]()
B.H2O(g) = H2O(1)的△S<0、△H=(a — b) kJ mol -1
C.当有4NA个O—H键生成时,反应放出的热量为a kJ
D.利用反应①设计的原电池电解精炼铜,当负极输出0.2NA个电子时. 理论上电解槽的阴极质量增重6.4 g