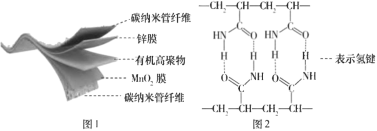
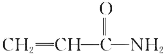题目内容
【题目】已知:
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1 452 kJ·mol-1
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
A. CH3OH(l)的燃烧热为1 452 kJ·mol-1
B. 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C. ![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)===
Ba(OH)2(aq)===![]() BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D. 3H2(g)+CO2(g)===CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol
【答案】B
【解析】
A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
B.设二者质量都是1g,然后根据题干热化学方程式计算;
C.酸碱中和反应生成的硫酸钡过程放热,则其焓变不是-57.3 kJ·mol-1;
D.①2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
②2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1,按盖斯定律计算①![]() 3-②得到:6H2(g)+2CO2(g)===2CH3OH(l)+2H2O(l) ,据此进行计算。
3-②得到:6H2(g)+2CO2(g)===2CH3OH(l)+2H2O(l) ,据此进行计算。
A.根据2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1可以知道1mol液态甲醇燃烧生成2mol液态水放出热量为726 kJ·mol-1,则CH3OH(l)燃烧热为726 kJ·mol-1,故A错误;
B.同质量的H2(g)和CH3OH(l)完全燃烧,设质量为1g
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
2mol 571.6 kJ
![]() mol 142.9 kJ
mol 142.9 kJ
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
2mol 1452 kJ
![]() mol 22.69 kJ
mol 22.69 kJ
所以H2(g)放出的热量多,所以B选项是正确的;
C.反应中有BaSO4(s)生成,而生成BaSO4也是放热的,所以放出的热量比57.3kJ多,即该反应的ΔH<-57.3 kJ·mol-1,故C错误;
D. ①2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
②2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1,按盖斯定律计算①![]() 3-②得到:6H2(g)+2CO2(g)===2CH3OH(l)+2H2O(l) ΔH=-262.8 kJ·mol-1,则正确的热化学方程式是:3H2(g)+CO2(g)===CH3OH(l)+H2O(l) ΔH=-131.4 kJ·mol-1,故D错误。
3-②得到:6H2(g)+2CO2(g)===2CH3OH(l)+2H2O(l) ΔH=-262.8 kJ·mol-1,则正确的热化学方程式是:3H2(g)+CO2(g)===CH3OH(l)+H2O(l) ΔH=-131.4 kJ·mol-1,故D错误。
所以B选项是正确的。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】设Na为阿伏加德罗常数的值。已知反应:
①CH4 (g) +2O2 (g) = CO2 (g) +2H2O(l) △H1 =a kJ mol -1
②CH4(g) + 2O2 (g) = CO2 (g) +2H2O(g) △H2 =bkJ mol-1
键能定义:在标准状况下,将1 mol气态分子AB(g)解离为气态原子
A(g)、B(g)所需的能量。已知1 mol氧气的键能为xkJ。其他数据如下 表所示,下列说法正确的是
化学键 | C—O | C—H | O—H |
键能/(kJ mol-1) | 798 | 413 | 463 |
A.上文中x=![]()
B.H2O(g) = H2O(1)的△S<0、△H=(a — b) kJ mol -1
C.当有4NA个O—H键生成时,反应放出的热量为a kJ
D.利用反应①设计的原电池电解精炼铜,当负极输出0.2NA个电子时. 理论上电解槽的阴极质量增重6.4 g