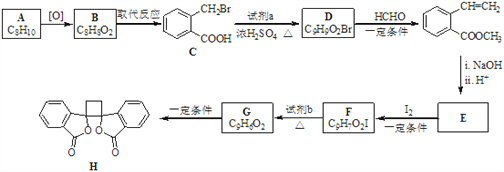
��Ŀ����
����Ŀ��ԭ�ӽṹ������
��1��Ԫ��As��Nͬ�塣As���⻯��е��NH3��___(��ߡ��͡�)�����ж�������______��
��2��ͭԭ���ڻ�̬ʱ�ļ۵����Ų�ʽΪ______��
��3��Fe��������Ҫ�����Ԫ��֮һ����д��Fe2���ĺ�������Ų�ʽ��_____����Alͬһ���ڵ�Na��MgԪ��Ҳ����������Ԫ�أ�Na��Mg��Al��̬ԭ�ӵ�һ�����ܵĴ�С��ϵ____��ijͬѧ������̬þԭ�ӵĺ�������Ų�ͼ��ͼ![]() ����ͬѧ�����ĵ����Ų�ͼΥ����______��
����ͬѧ�����ĵ����Ų�ͼΥ����______��
��4��KԪ�ش���Ԫ�����ڱ���____�������̬ԭ���У��������ռ�ݵĵ���������ͼΪ���ε��ܼ���____����
���𰸡��� ��������֮����������AsH3���Ӽ�Ϊ���»��� 3d104s1 1s22s22p63s23p63d6 Na��Al��Mg �������ԭ�� s 4
��������
(1)��������֮����������AsH3���Ӽ�Ϊ���»���������ȽϷ��»�����ǿ��
(2)��������Ų�ʽ����дҪע����ع����������Cu��29��Ԫ�أ�
(3)��Ԫ��Ϊ26��Ԫ�أ�ʧȥ2���Ӻ��γ�Fe2+��ͬһ����Ԫ�ص�һ����������ԭ��������������������ƣ�����IIA�塢��VA��Ԫ�ص�һ�����ܴ���������Ԫ�أ�Na��Mg��Al����ͬһ����Ԫ�أ�����Ӧ����������3s�ܼ���
(4)KԪ�ش���Ԫ�����ڱ���s�������̬ԭ���У��������ռ�ݵĵ���������ͼΪ���ε��ܼ�Ϊns�ܼ���
(1)��������֮����������AsH3���Ӽ�Ϊ���»���������ȽϷ��»�����ǿ����AsH3�ķе�Ƚ�NH3�ĵͣ�
(2)Cu��29��Ԫ�أ���������Ų�ʱ��Ҫ��ѭ���ع�����������ʼ۵����Ų�ʽ��3d104s1��
(3)��Ԫ��Ϊ26��Ԫ�أ����������Ų�Ϊ1s22s22p63s23p63d64s2��ʧȥ2���Ӻ��γ�Fe2+����Fe2+�ĺ�������Ų�Ϊ��1s22s22p63s23p63d6��ͬһ����Ԫ�ص�һ����������ԭ��������������������ƣ�����IIA�塢��VA��Ԫ�ص�һ�����ܴ���������Ԫ�أ���Na��Mg��Al��̬ԭ�ӵ�һ�����ܵĴ�С��ϵ��Na��Al��Mg������Ӧ����������3s�ܼ���Υ�����������ԭ����
(4)KԪ�ش���Ԫ�����ڱ���s�������̬ԭ���У��������ռ�ݵĵ���������ͼΪ���ε��ܼ�Ϊns�ܼ����ֱ���1s��2s��3s��4s�����������ռ�ݵĵ���������ͼΪ���ε��ܼ���4����

����Ŀ������ʵ�������ʵ������������������һ���ǣ� ��
ѡ�� | ʵ����������� | ʵ����� |
A | ��ij������Ʒ�м���Ba(OH)2��Һ���а�ɫ�������� | ����������һ����SO42- |
B | ��KI-������Һ�е�����ˮ����Һ�����ɫ | I-�Ļ�ԭ��ǿ��Cl- |
C | ��Ba(OH)2��8H2O��NH4Cl������С�ձ��л�Ͻ��裬���ִ����ձ���ڸо����� | Ba(OH)2��8H2O��NH4Cl�ķ�Ӧ�����ȷ�Ӧ |
D | ��ij����Һ�м���NaOH��Һ�����ȣ���ʪ��ĺ�ɫʯ����ֽ�����Թܿڣ���ֽ���� | ������Һ�к���NH4+ |
A.AB.BC.CD.D
����Ŀ����NaΪ�����ӵ�������ֵ����֪��Ӧ��
��CH4 (g) +2O2 (g) = CO2 (g) +2H2O(l) ��H1 =a kJ mol -1
��CH4(g) + 2O2 (g) = CO2 (g) +2H2O(g) ��H2 =bkJ mol-1
���ܶ��壺�ڱ�״���£���1 mol��̬����AB(g)����Ϊ��̬ԭ��
A(g)��B(g)�������������֪1 mol�����ļ���ΪxkJ�������������� ����ʾ������˵����ȷ����
��ѧ�� | C��O | C��H | O��H |
����/(kJ mol-1) | 798 | 413 | 463 |
A.������x=![]()
B.H2O(g) = H2O(1)����S<0����H=(a �� b) kJ mol -1
C.����4NA��O��H������ʱ����Ӧ�ų�������Ϊa kJ
D.���÷�Ӧ����Ƶ�ԭ��ص�⾫��ͭ�����������0.2NA������ʱ. �����ϵ��۵�������������6.4 g