题目内容
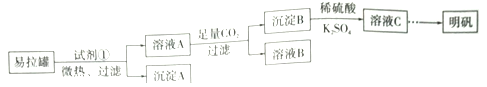
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:

(1)装置A的分液漏斗中盛装的试剂是____________,烧瓶中发生的反应的化学方程式是______________________。
(2)画出虚线框内的实验装置图,所加试剂为____________,该装置的作用是__________________。
(3)装置B中盛放的试剂是____________(填序号),实验现象为____________________________,该反应的离子方程式是____________________________,该反应属于四种基本反应类型中的__________反应。
A.Na2S溶液 B.Na2SO3溶液
C.Na2SO4溶液
(4)已知:①硫酸比次氯酸稳定;②高氯酸的酸性比硫酸强;③S2-比Cl-易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,但能与浓硫酸反应;⑥铁与氯气在加热条件下反应生成三氯化铁,铁与硫在加热条件下反应生成硫化亚铁;⑦硫原子与氯原子的电子层数相同,氯的原子半径小于硫原子。能说明氯的非金属性比硫强的是________(填序号)。
A.全部 B.②③④⑥⑦
C.①②④⑤⑥ D.②③④⑤⑥⑦
(5)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气,写出该装置中所发生反应的离子方程式:________________________。
【答案】浓盐酸 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O ![]() 饱和食盐水 除去Cl2中的HCl气体 A 有淡黄色沉淀生成 S2-+Cl2===2Cl-+S↓ 置换 B Cl2+2OH-===Cl-+ClO-+H2O
饱和食盐水 除去Cl2中的HCl气体 A 有淡黄色沉淀生成 S2-+Cl2===2Cl-+S↓ 置换 B Cl2+2OH-===Cl-+ClO-+H2O
【解析】
(1)为验证氯元素的非金属性比硫元素的非金属性强,根据实验装置的特点,可以确定需要用氯气置换出硫,则必须用装置A制备氯气,从实验室制取氯气的原理分析解答此题;
(2)由于用浓盐酸制取氯气需要加热,实验过程中会挥发出HCl气体,因此虚线框部分应是除去HCl气体的装置,可以使用洗气瓶,所用装置为洗气装置;
(3)要在B中发生氯气置换出硫的反应,在给定试剂中只能选取Na2S溶液;
(4)比较元素的非金属性强弱可根据:元素对应最高价氧化物的水化物的酸性;氢化物的还原性、稳定性强弱;与氢气反应的难易程度以及单质的氧化性的强弱等角度;
(5)装置C中盛放烧碱溶液,用易吸收多余的氯气,防止污染空气。
(1)实验室通常用浓盐酸与二氧化锰反应制取氯气,则A装置中的分液漏斗中盛装的试剂是浓盐酸,反应的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
本题答案为:浓盐酸、MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(2)由于用浓盐酸制取氯气需要加热,实验过程中会挥发出HCl气体,因此虚线框部分应是除去HCl气体的装置,可以使用洗气瓶,瓶内盛装饱和食盐水,既除去HCl,又降低氯气在水中的溶解度.所用装置为: ![]() ;
;
本题答案为:![]() ,饱和食盐水,除去Cl2中的HCl气体。
,饱和食盐水,除去Cl2中的HCl气体。
(3)要在B中发生氯气置换出硫的反应,氯元素的非金属性比硫元素的非金属性强,在给定试剂中只能选取Na2S溶液,发生的是置换反应,生成淡黄色的S沉淀,化学方程式为:Na2S+Cl2=2NaCl+S↓;
本题答案为:A,有淡黄色沉淀生成,Na2S+Cl2=2NaCl+S↓,置换。
(4)①硫酸比次氯酸稳定,不能用来比较非金属性强弱;
②元素对应最高价氧化物的水化物的酸性越强,对应的元素的非金属性越强,可说明非金属性Cl>S;
③元素的非金属性越强,对应单质的氧化性越强,则阴离子的还原性越弱,S2-比Cl-易被氧化,可说明非金属性Cl>S,;
④元素的非金属性越强,氢化物越稳定,HCl比H2S稳定,可说明非金属性Cl>S;
⑤铜与盐酸不反应,但能与浓硫酸反应,不能判断非金属性强弱;
⑥铁与氯气加热生成三氯化铁,铁与硫加热生成硫化亚铁,说明氯气的氧化性比硫强,则可说明非金属性Cl>S;
⑦硫原子与氯原子的电子层数相同,氯的原子半径小于硫原子,说明氯元素的原子比硫元素的原子更容易得到电子,则可说明氯元素的非金属性比硫元素强。
综上所述,能说明氯的非金属性比硫强的是②③④⑥⑦;
本题答案为B。
(5)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气,反应的离子方程式为:Cl2+2OH-===Cl-+ClO-+H2O;
本题答案为:Cl2+2OH-===Cl-+ClO-+H2O。