题目内容
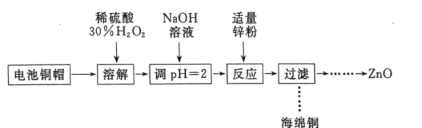
【题目】实验室利用废弃旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO的部分实验过程如图所示:
下列叙述错误的是( )
A. “溶解”操作中可用酸性条件下不断鼓入O2代替H2O2
B. 铜帽溶解后,将溶液加热至沸腾以除去溶液中过量的H2O2
C. 与加入锌粉反应的离子为Cu2+、H+
D. “过滤”操作后,将滤液蒸干、高温灼烧即可制取纯净的ZnO
【答案】D
【解析】
利用废旧电池的铜帽(主要成分为Zn和Cu)回收 Cu并制备ZnO,电池铜帽加入稀硫酸、过氧化氢溶解,铜生成硫酸铜溶液,加热煮沸将溶液中过量的H2O2除去,加入氢氧化钠溶液调节溶液PH=2沉淀铁离子,加入锌粉反应过滤得到海绵铜,沉淀锌离子得到氢氧化锌,分解得到氧化锌。
A.酸性条件下,通入氧气可把铜氧化生成硫酸铜,故A正确;
B.铜帽溶解后,溶液中存在过氧化氢,将溶液加热至沸腾,H2O2受热分解,可除去溶液中过量的H2O2,故B正确;
C.固体溶解中溶液中存在Cu2+、H+,二者都与锌反应,故C正确;
D.滤液中含有硫酸锌和硫酸钠,将滤液蒸干得到ZnSO4和Na2SO4,高温灼烧时硫酸锌分解而硫酸钠,故不能得到纯净的ZnO,故D错误。
故选D。

 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入2L的恒容密闭容器中,在一定条件下发生反应PCl3(g)+Cl2(g)![]() PCl5(g),△H<0并于10 min时达到平衡。有关数据如下:
PCl5(g),△H<0并于10 min时达到平衡。有关数据如下:
PCl3(g) | Cl2(g) | PCl5(g) | |
初始浓度/(mol·L-1) | 2.0 | 1.0 | 0 |
平衡浓度/(mol·L-1) | c1 | c2 | 0.4 |
下列判断不正确的是
A. 10 min内,v(Cl2)=0.04 mol/( L·min)
B. 升高温度,反应的平衡常数增大
C. 反应达到平衡时容器内的压强与初始时容器的压强之比为13:15
D. 平衡后移走2.0 mol PCl3和1.0 mol Cl2,相同条件下再达平衡时,c(PCl5)<0.2 mol·L-1