题目内容
【题目】第ⅠA、ⅦA族元素及其化合物在生活、生产中有广泛应用。回答下列问题:
(1)基态钠原子核外电子排布式为_______;ⅠA族元素的基态原子价层电子云轮廓图为_______。
(2)H2分子中轨道重叠方式是________( 填标号)。
A.s-s B.s-p C.p-p
与H2F+互为等电子体的分子是________( 填一种即可)。
(3)OF2、O2F2是氟化物。OF2 分子的中心原子杂化类型是________;氯的含氧酸通式表示为HClOx,若某种氯的含氧酸中阴离子立体构型为三角锥形,则x=________。
(4)碱金属单质的熔点随原子序数增大而降低,而卤素单质的熔点,沸点随原子序数增大而升高,其原因是________________________________。
(5)钠、钾晶胞如图A所示,其堆积方式是________。



(6)氢化钠晶胞如图B所示(白球代表H+,黑球代表Na+),图C是氢化钠晶胞的截面图。
已知NA代表阿伏加德罗常数的值,晶体密度为dg·cm-3。
①氢化钠晶胞中阴离子的配位数为________。
②Na+半径为________pm(只列出计算式即可)。
【答案】 1s22s22p43s1 球形 A H2O sp3 3 碱金属晶体是金属晶体,随着原子序数增大,离子半径增大,金属键减弱;卤素单质晶体是分子晶体,组成和结构相似,随着原子序数增大,相对分子质量增大,分子间范德华力增大 体心立方堆积 6 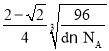 ×1010
×1010
【解析】(1)钠为11号元素,基态钠原子核外电子排布式为1s22s22p43s1;ⅠA族元素的基态原子价层电子为n s1,电子云轮廓图为球形,故答案为:1s22s22p43s1;球形;
(2)H2分子中轨道重叠方式是s-s,故选A;与H2F+互为等电子体的分子有H2O、H2S等,故答案为:A;H2O;
(3) OF2分子的中心原子为O,连接的原子数为2,含有2对孤电子对,采用sp3杂化;氯的含氧酸通式表示为HClOx,若某种氯的含氧酸中阴离子立体构型为三角锥形,说明连接的原子个数为3,含有1个孤电子对,则x=3,故答案为:sp3;3;
(4) 碱金属晶体是金属晶体,随着原子序数增大,离子半径增大,金属键减弱,导致碱金属单质的熔点随原子序数增大而降低;卤素单质晶体是分子晶体,组成和结构相似,随着原子序数增大,相对分子质量增大,分子间范德华力增大,导致卤素单质的熔点,沸点随原子序数增大而升高,故答案为:碱金属晶体是金属晶体,随着原子序数增大,离子半径增大,金属键减弱卤素单质晶体是分子晶体,组成和结构相似,随着原子序数增大,相对分子质量增大,分子间范德华力增大;
(5)根据钠、钾晶胞结构图,其堆积方式为体心立方堆积,故答案为:体心立方堆积;
(6)①根据氢化钠晶胞结构图B,立方体中心的钠离子与6个面的面心的氢离子距离相等且最近,即钠离子的配位数为6,在晶胞中阴阳离子的个数比为(8×![]() +6×
+6×![]() ):(12×
):(12×![]() +1)=1:1,因此阴离子的配位数也为6,故答案为:6;
+1)=1:1,因此阴离子的配位数也为6,故答案为:6;
②设氢离子的半径为x,钠离子半径为y,则![]() (2x+2y)=4x,解得x=
(2x+2y)=4x,解得x=![]() y,晶体密度dg·cm-3,则晶胞的边长=
y,晶体密度dg·cm-3,则晶胞的边长=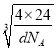 cm=
cm=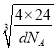 ×1010pm,因此2x+2y=
×1010pm,因此2x+2y=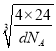 ×1010,则y=
×1010,则y=![]() ×
×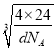 ×1010pm,故答案为:
×1010pm,故答案为: ![]() ×
× ×1010。
×1010。

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案【题目】—定温度下,难溶电解质的饱和溶液中存在沉淀溶解平衡,己知:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
KSP(25℃) | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
25℃时,对于CuSO4、FeSO4、Fe2(SO4)3各0.5mol的1L混合溶液,根据上表数据断,下列说法不正确的是( )
A. 向混合溶液中加入适量氨水,并调节pH在3~4后过滤,可获得纯净的CuSO4溶液
B. 向混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
C. 该溶液中c(SO42-):[c(Cu2+)+ c(Fe2+)+c(Fe3+)]>5:4
D. 在pH=5的溶液中.Fe3+不能大量存在
【题目】如表是A、B、C、D、E五种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色 ②比例模型为 ③能与水在一定条件下反应生成C |
B | ①由C、H两种元素组成 ②球棍模型为 |
C | ①由C、H、O三种元素组成 ②能与Na反应 ③与E反应生成相对分子质量为88的酯 |
D | ①相对分子质量比C少2 ②能由C催化氧化得到 |
E | ①由C、H、O三种元素组成 ②其水溶液能使紫色石蕊溶液变红 ③可由C发生氧化反应得到 |
回答下列问题:
(1)A~E中,属于烃的是________(填字母)。
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为_______。
(3)C催化氧化生成D的化学方程式为_____________________。
(4)有机物B具有的性质是________(填序号)。
①无色无味的溶液;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色
(5)写出B与溴在催化剂作用下发生反应的化学方程式为_______。
(6)写出E与C反应生成相对分子质量为88的酯的化学方程式为______。







