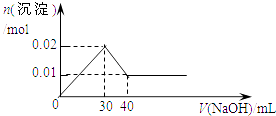题目内容
【题目】下图所示为镍锌可充电电池放电时电极发生物质转化的示意图,电池使用KOH和K2Zn(OH)4为电解质溶液,下列关于该电池说法正确的是

A. 放电时溶液中的K+移向负极
B. 充电时阴极附近的pH会升高
C. 放电时正极反应为H++NiOOH+e-=Ni(OH)2
D. 负极质量每减少6.5g,溶液质量增加6.3g
【答案】BD
【解析】根据镍锌可充电电池放电时电极发生物质转化的示意图中电子的移动方向,锌为分解,失去电子生成K2Zn(OH)4,NiOOH为正极,得到电子生成Ni(OH)2。A. 原电池中阳离子向正极移动,故A错误;B. 充电时阴极发生的电极反应是放电时负极的逆反应,反应后电极附近的pH会升高,故B正确;C. 放电时NiOOH为正极,得到电子生成Ni(OH)2,电解质溶液显碱性,正极反应为NiOOH+e-+H2O=Ni(OH)2+ OH-,故C错误;D. 负极质量每减少6.5g,即0.1mol锌,转移0.2mol电子,正极上0.1molNiOOH转化为0.1molNi(OH)2,质量增加0.2g,溶液质量增加6.5g-0.2g=6.3g,故D正确;故选BD。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
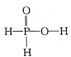
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案【题目】二氧化氯(ClO2)是极易溶于水且不发生化学反应的黄绿色气体,沸点为11℃,可用于处理含硫废水.某小组在实验室中探究ClO2与Na2S的反应.回答下列问题:
(1)ClO2的制备(已知SO2+2NaClO3+H2SO4═2ClO2↑+2NaHSO4)置A中反应的化学方程式为 . ②欲收集干燥的ClO2 , 选择图1中的装置,其连接顺序为a→(按气流方向,用小写字母表示)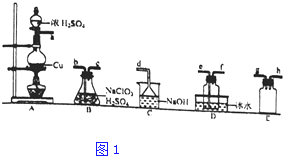
③装置D的作用是 .
(2)ClO2与Na2S的反应 将上述收集到的ClO2用N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入图2所示装置中充分反应,得到无色澄清溶液.一段时间后,通过下列实验探究I中反应的产物.
操作步骤 | 实验现象 | 结论 |
取少量I中溶液于试管甲中,滴加品红溶液和盐酸 | 品红始终不褪色 | ①无_生成 |
另取少量I中溶液于试管乙中,加入Ba(OH)2溶液,振荡 | ② | 有SO42﹣ |
③继续在试管乙中滴加Ba(OH)2溶液至过量,静置,取上层清液于试管丙中, | 有白色沉淀生成 | 有Cl﹣生成 |
④ClO2与Na2S反应的离子方程式为 .