题目内容
20.已知 2SO2(g)+O2(g)?2SO3△H=-197KJ/mol下列说法正确的是( )| A. | 其他条件不变,改变反应物的量,△H发生改变 | |
| B. | 上述反应生成1mol SO3,放热少于98.5KJ | |
| C. | 相同条件下加入2molSO2(g)、1mol O2(g) 充分反应放热等于197KJ | |
| D. | 相同条件下加入1molSO2(g)、0.5mol O2(g) 充分反应放热为Q1 kJ,若在相同容器中加入1mol SO3充分反应吸热等于Q2kJ,Q1kJ+Q2 kJ=98.5kJ |
分析 A、△H只与反应的系数和物质的状态有关;
B、生成1mol SO3,放热98.5kJ;
C、可逆反应不可能反应到底;
D、根据1molSO2(g)、0.5mol O2(g) 充分反应和相同容器中加入1mol SO3充分反应为等效平衡分析.
解答 解:A、△H只与反应的系数和物质的状态有关,所以改变反应物的量,△H不变,故A错误;
B、根据2SO2(g)+O2(g)═2SO3△H=-197KJ/mol,则生成1mol SO3,放热98.5KJ,故B错误;
C、因为可逆反应不可能反应到底,所以2molSO2(g)、1mol O2(g) 充分反应放热小于197KJ,故C错误;
D、因为1molSO2(g)、0.5mol O2(g) 充分反应和相同容器中加入1mol SO3充分反应为等效平衡,所以Q1 KJ+Q2 KJ=98.5KJ,故D正确.
故选D.
点评 本题考查反应热的计算和比较,侧重于平衡移动的考查,为高考常见题型和高频考点,题目难度中等,本题注意可逆反应的特征.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
11.在一定条件下,反应2HI(g)?H2(g)+I2(g)(正反应吸热)达到平衡时,要使混合气体的颜色加深(I2有颜色),可采取的措施是( )
①增大氢气的浓度②升高温度③降低温度④缩小体积⑤增大HI的浓度⑥减小压强⑦加催化剂.
①增大氢气的浓度②升高温度③降低温度④缩小体积⑤增大HI的浓度⑥减小压强⑦加催化剂.
| A. | ①③⑥⑦ | B. | ③⑤⑥ | C. | ①③⑤ | D. | ②④⑤ |
8.下列中心原子采取sp2杂化且为非极性分子的是( )
| A. | CS2 | B. | H2S | C. | SO2 | D. | SO3 |
15.下列叙述正确的是:( )
①硫酸钡难溶于水和酸,可做X光透视肠胃的药剂
②蛋白质遇酒精会变性,医疗中用99%的乙醇溶液进行消毒
③光导纤维的主要成分是二氧化硅
④氢氧化铁胶体具有杀菌净水作用
⑤碳酸钠、氢氧化钠、碳酸氢钠等都可以中和酸,故都可以作为治疗胃酸过多的药物
⑥可以用二氧化硅和水反应制备硅酸胶体.
①硫酸钡难溶于水和酸,可做X光透视肠胃的药剂
②蛋白质遇酒精会变性,医疗中用99%的乙醇溶液进行消毒
③光导纤维的主要成分是二氧化硅
④氢氧化铁胶体具有杀菌净水作用
⑤碳酸钠、氢氧化钠、碳酸氢钠等都可以中和酸,故都可以作为治疗胃酸过多的药物
⑥可以用二氧化硅和水反应制备硅酸胶体.
| A. | ②③④ | B. | ①③ | C. | ①②④ | D. | ①③⑥ |
12.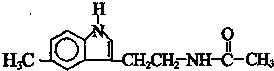 脑白金可以调整人体生物节律,达到改善睡眠的作用,是一种良好的保健品.脑白金主要成分的结构简式如图所示,下列对脑白金主要成分的推论正确的是( )
脑白金可以调整人体生物节律,达到改善睡眠的作用,是一种良好的保健品.脑白金主要成分的结构简式如图所示,下列对脑白金主要成分的推论正确的是( )
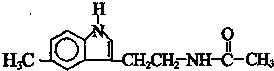 脑白金可以调整人体生物节律,达到改善睡眠的作用,是一种良好的保健品.脑白金主要成分的结构简式如图所示,下列对脑白金主要成分的推论正确的是( )
脑白金可以调整人体生物节律,达到改善睡眠的作用,是一种良好的保健品.脑白金主要成分的结构简式如图所示,下列对脑白金主要成分的推论正确的是( )| A. | 该物质有苯环属于芳香烃,1mol该物质能与5molH2加成 | |
| B. | 其分子式为C13H15N2O | |
| C. | 该物质不能与溴水反应 | |
| D. | 该物质能发生水解反应并生成乙酸 |
9.下列反应的离子方程式书写正确的是( )
| A. | 明矾溶液中加入过量的氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | 铜粉与98.3%的硫酸加热下反应 Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O | |
| C. | 氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ | |
| D. | 澄清石灰水中加入少量的NaHCO3溶液:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
4.下列反应属于氧化还原反应的是( )
| A. | H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$H2O+Cu | B. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | ||
| C. | Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O | D. | CaCO3+2HCl═CaCl2+H2O+CO2↑ |