题目内容
1.有机物结构如图所示,下列说法中不正确的是( )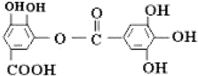
| A. | 常温下,能与NaHCO3溶液反应放出CO2 | |
| B. | 该有机物的分子式为C14H10O9 | |
| C. | 与稀H2SO4共热,生成2种有机物 | |
| D. | 能发生碱性水解反应,1mol该有机物完全反应消耗掉8molNaOH |
分析 由结构简式可知,有机物中分子含5个酚-OH、1个COOH、1个-COOC-,结合酚、羧酸、酯性质来解答.
解答 解:A.含-COOH,则常温下,能与NaHCO3溶液反应放出CO2,故A正确;
B.由结构简式可知,该有机物的分子式为C14H10O9,故B正确;
C.由结构的对称性可知,与稀H2SO4共热,生成1种有机物,苯环上含3个相邻的-OH,与中间-OH对位上为-COOH,故C错误;
D.含-COOC-,能发生碱性水解反应,5个酚-OH、1个COOH、1个-COOC-,均与碱反应,且水解生成的酚-OH也反应,则1mol该有机物完全反应消耗掉8molNaOH,故D正确.
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酚、羧酸、酯性质的考查,题目难度不大.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目
11.在一定条件下,反应2HI(g)?H2(g)+I2(g)(正反应吸热)达到平衡时,要使混合气体的颜色加深(I2有颜色),可采取的措施是( )
①增大氢气的浓度②升高温度③降低温度④缩小体积⑤增大HI的浓度⑥减小压强⑦加催化剂.
①增大氢气的浓度②升高温度③降低温度④缩小体积⑤增大HI的浓度⑥减小压强⑦加催化剂.
| A. | ①③⑥⑦ | B. | ③⑤⑥ | C. | ①③⑤ | D. | ②④⑤ |
12.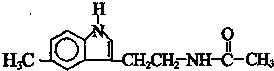 脑白金可以调整人体生物节律,达到改善睡眠的作用,是一种良好的保健品.脑白金主要成分的结构简式如图所示,下列对脑白金主要成分的推论正确的是( )
脑白金可以调整人体生物节律,达到改善睡眠的作用,是一种良好的保健品.脑白金主要成分的结构简式如图所示,下列对脑白金主要成分的推论正确的是( )
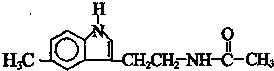 脑白金可以调整人体生物节律,达到改善睡眠的作用,是一种良好的保健品.脑白金主要成分的结构简式如图所示,下列对脑白金主要成分的推论正确的是( )
脑白金可以调整人体生物节律,达到改善睡眠的作用,是一种良好的保健品.脑白金主要成分的结构简式如图所示,下列对脑白金主要成分的推论正确的是( )| A. | 该物质有苯环属于芳香烃,1mol该物质能与5molH2加成 | |
| B. | 其分子式为C13H15N2O | |
| C. | 该物质不能与溴水反应 | |
| D. | 该物质能发生水解反应并生成乙酸 |
9.下列反应的离子方程式书写正确的是( )
| A. | 明矾溶液中加入过量的氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | 铜粉与98.3%的硫酸加热下反应 Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O | |
| C. | 氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ | |
| D. | 澄清石灰水中加入少量的NaHCO3溶液:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
4.下列反应属于氧化还原反应的是( )
| A. | H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$H2O+Cu | B. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | ||
| C. | Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O | D. | CaCO3+2HCl═CaCl2+H2O+CO2↑ |
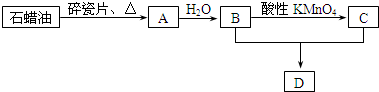
 CH3CH2OH反应类型是加成反应;B+C→D的化学方程式为:CH3COOH+C2H5OH
CH3CH2OH反应类型是加成反应;B+C→D的化学方程式为:CH3COOH+C2H5OH  CH3COOC2H5+H2O.反应类型是酯化反应或取代反应;
CH3COOC2H5+H2O.反应类型是酯化反应或取代反应;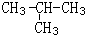 .
.