题目内容
8.向一定量铁、氧化铁、四氧化三铁的混合物中加入250ml 2mol/L的硝酸溶液,反应完全后生成1.12LNO(标准状况),再向反应后的溶液中加1mol/L的氢氧化钠溶液,要使铁元素完全沉淀下来,所加NaOH溶液的体积最少是( )| A. | 400ml | B. | 450ml | C. | 500ml | D. | 无法确定 |
分析 反应中硝酸体现两种性质,一是酸性,以NO3-离子存在溶液中,另一种是氧化性,被还原为NO,加入NaOH后,溶液的溶质为硝酸钠,根据N元素守恒计算氢氧化钠的物质的量,再根据V=$\frac{n}{c}$计算出需要氢氧化钠溶液的最小体积.
解答 解:当所加入的NaOH恰好使铁元素沉淀,此时溶液为硝酸钠溶液,根据N元素守恒可求出NaOH的量
n(NaOH)=n(NO3-)=n(HNO3)-n(NO)=0.25L×2mol/L-$\frac{1.12L}{22.4L/mol}$=0.45mol,
所以V(NaOH)=$\frac{0.45mol}{1mol/L}$=0.45L=450ml,
故选B.
点评 本题考查有关混合物的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题侧重分析与计算能力的考查.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案
相关题目
18.W、X、Y、Z 均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、6、8、8,它们的最外层电子数之和为10,下列说法正确的是( )
| A. | W 与Y 可以形成离子化合物 | |
| B. | X 的简单氢化物在同主族元素的氢化物中沸点最高,说明X 的非金属性最强 | |
| C. | X 和Z 形成的原子个数l:1 的化合物中,既含有极性键又含有非极性键 | |
| D. | 工业生产中,通常用电解Z 的熔融氧化物来制取Z 的单质 |
19.用托盘天平称取10.1g NaOH试样,下列操作中,正确的是( )
| A. | 将NaOH放在天平左边托盘中的纸片上 | |
| B. | 用镊子取出标定为10.1g的砝码放在天平右边的托盘上 | |
| C. | 将NaOH放入烧杯中(烧杯事先已称重),并放在天平右边托盘上 | |
| D. | 将NaOH放入烧杯中,若烧杯质量为42.5g,则应将游码向右移到2.6g位置上 |
16.下列说法不正确的是( )
①将CO2通入溶有足量氨的BaCl2溶液中,无白色沉淀生成
②向某溶液中滴入盐酸酸化的BaCl2溶液产生白色沉淀,证明溶液中一定含有SO42-
③将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,放入水中,两者放出的氢气质量相等
④氢氧化铝具有弱碱性,可用于制胃酸中和剂.
①将CO2通入溶有足量氨的BaCl2溶液中,无白色沉淀生成
②向某溶液中滴入盐酸酸化的BaCl2溶液产生白色沉淀,证明溶液中一定含有SO42-
③将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,放入水中,两者放出的氢气质量相等
④氢氧化铝具有弱碱性,可用于制胃酸中和剂.
| A. | 只有② | B. | 只有②③ | C. | ①②③ | D. | ①②③④ |
3.下列叙述正确的是( )
| A. | 分散质微粒直径的大小关系:溶液>胶体>浊液 | |
| B. | 胶体粒子很小,但不能通过半透膜 | |
| C. | Fe(OH)3胶体带正电荷 | |
| D. | 向沸水中加入Fe(OH)3可制得Fe(OH)3胶体 |
17.下列说法正确的是( )
| A. | 100℃时,pH=10的NaOH溶液与pH=2的H2SO4溶液等体积混合,则两者恰好中和,溶液的pH=7 | |
| B. | 室温下,将pH=2的盐酸与pH=12的氨水等体积混合后,溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 室温下,pH=3的盐酸与pH=12的NaOH溶液按体积比1:10混合后,溶液pH=7 | |
| D. | 室温下,在pH=11的某溶液中,由水电离出的c(H+)可能为10-3mol/L或10-11mol/L |
18.下列离子方程式正确的是( )
| A. | 硫化钠水解:S2-+2H2O?H2S+2OH- | |
| B. | Al投入NaOH溶液中:Al+OH-+H2O=AlO2-+H2↑ | |
| C. | Fe投入盐酸中:2Fe+6H+=2Fe3++3H2↑ | |
| D. | Na2SiO3溶液中加入盐酸:SiO32-+2H++H2O=H4SiO4↓ |
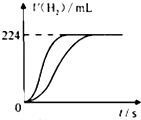 量取8.0mL 5.0mol•L-1H2SO4溶液,加蒸馏水稀释至100mL,取两份稀释后的H2SO4溶液各25mL,分别加入等质量的Zn和Fe,相同条件下充分反应,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积).请计算:
量取8.0mL 5.0mol•L-1H2SO4溶液,加蒸馏水稀释至100mL,取两份稀释后的H2SO4溶液各25mL,分别加入等质量的Zn和Fe,相同条件下充分反应,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积).请计算: