题目内容
【题目】下列有关叙述及相关解释均正确的是( )
选项 | 叙述 | 解释 |
A | 键的极性的强弱:N-H>O-H>F-H | 电负性:N<O<F |
B | 石墨的熔点高于金刚石 | 碳碳键的键长:石墨<金刚石 |
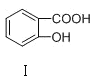
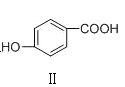
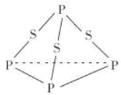
C | 熔点: | Ⅰ形成分子内氢键,Ⅱ形成分子间氢键 |
D | 酸性:HI>HBr>HCl | HI、HBr、HCl中的范德华力逐渐减小 |
A.AB.BC.CD.D
【答案】B
【解析】
A.电负性:N<O<F,键的极性的强弱:N-H<O-H<F-H,故A错误;
B.碳碳键的键长:石墨<金刚石,石墨的熔点高于金刚石,故B正确;
C.Ⅰ形成分子内氢键,分子间作用力小,Ⅱ形成分子间氢键,分子间作用力大,熔点: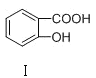 <
<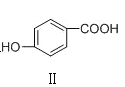 ,故C错误;
,故C错误;
D.酸性:HI>HBr>HCl,HI、HBr、HCl中共价键越来越强,在水中电离能力变弱,故D错误;
故选B。

练习册系列答案
相关题目