题目内容
【题目】N4分子结构如图所示,已知断裂1molN-N键吸收167kJ热量,生成1molN≡N放出945kJ热量。根据以上信息和数据,下列说法正确的是( )
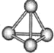
A.N4属于由非极性键构成的极性分子
B.氮元素非金属性比磷强,可知N4沸点比P4(白磷)高
C.1molN4气体转变为N2气体放出888kJ热量
D.N4和N2互为同位素
【答案】C
【解析】
A.N4属于由非极性键构成的非极性分子,故A错误;
B.氮相对原子质量比磷小,N4的相对分子质量比P4(白磷)小,可知N4沸点比P4(白磷)低,故B错误;
C.1molN4气体中含有6molN-N键,可生成2molN2,形成2molN≡N键,则1molN4气体转变为N2化学键断裂断裂吸收的热量为6×167kJ=1002kJ,形成化学键放出的热量为1884kJ,所以反应放热,放出的热量为1884kJ-1002kJ=882kJ,故放出882kJ热量,故C正确;
D.质子数相同,中子数不同的两种核素之间互为同位素,N4与N2互称为同素异形体,故D错误;
故选C。

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案
相关题目
【题目】下列有关叙述及相关解释均正确的是( )
选项 | 叙述 | 解释 |
A | 键的极性的强弱:N-H>O-H>F-H | 电负性:N<O<F |
B | 石墨的熔点高于金刚石 | 碳碳键的键长:石墨<金刚石 |
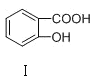
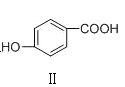
C | 熔点: | Ⅰ形成分子内氢键,Ⅱ形成分子间氢键 |
D | 酸性:HI>HBr>HCl | HI、HBr、HCl中的范德华力逐渐减小 |
A.AB.BC.CD.D