题目内容
【题目】一定量的镁粉和铝粉混合粉末加入过量的盐酸溶解后,再向所得溶液中加入氢氧化钠溶液,得到的沉淀的物质的量与加入氢氧化钠的物质的量关系如图所示。
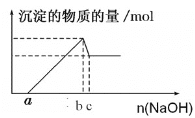
求:
⑴混合粉末中镁粉、铝粉各多少克______?
⑵加入盐酸的物质的量是多少______?
【答案】Al的质量为27(c-b)g,Mg的质量为12(4b-a-3c)g b mol
【解析】
因为盐酸过量,所以氢氧化钠先和盐酸反应,盐酸反应完毕后,氢氧化钠和溶液中的铝离子和镁离子反应,最后和氢氧化铝沉淀反应。
⑴设Al的物质的量为x,Mg的物质的量为y。

1mol:xmol = 1mol:(c-b)mol
解得x=(c-b)mol,所以铝粉的质量为27(c-b)g,由![]() 可知,生成氢氧化铝消耗的氢氧化钠的物质的量为3(c-b)mol,
可知,生成氢氧化铝消耗的氢氧化钠的物质的量为3(c-b)mol,![]() 消耗的氢氧化钠为(b-a) mol-3(c-b)mol =(4b-a-3c) mol,则氯化镁的物质的量为0.5(4b-a-3c) mol,镁粉的质量为12(4b-a-3c)g;故答案为: Al的质量为27(c-b)g,Mg的质量为12(4b-a-3c)g;
消耗的氢氧化钠为(b-a) mol-3(c-b)mol =(4b-a-3c) mol,则氯化镁的物质的量为0.5(4b-a-3c) mol,镁粉的质量为12(4b-a-3c)g;故答案为: Al的质量为27(c-b)g,Mg的质量为12(4b-a-3c)g;
⑵b点时沉淀量达到最大,此时溶液为NaCl溶液,![]() ,故答案为:bmol。
,故答案为:bmol。

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
【题目】下列有关叙述及相关解释均正确的是( )
选项 | 叙述 | 解释 |
A | 键的极性的强弱:N-H>O-H>F-H | 电负性:N<O<F |
B | 石墨的熔点高于金刚石 | 碳碳键的键长:石墨<金刚石 |
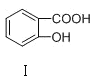
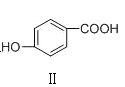
C | 熔点: | Ⅰ形成分子内氢键,Ⅱ形成分子间氢键 |
D | 酸性:HI>HBr>HCl | HI、HBr、HCl中的范德华力逐渐减小 |
A.AB.BC.CD.D