题目内容
【题目】亚氯酸钠(NaClO2)是一种重要的杀菌消毒剂。以氯酸钠(NaC1O3)为原料 制备NaC1O2粗品的工艺流程如下图所示。

己知:①纯C1O2易分解爆炸,空气中C1O2的体积分数在10%以下比较安全。
②NaClO2高于60°C会分解。
(1)反应I的离子方程式为____;反应中需同时鼓入空气的主要目的是____ °
(2)“合成”过程中的氧化剂是______。
(3)蒸发时,需要减压的目的是_____。
(4)“冷却结晶”后获得NaClO,粗产品的操作是_____(填操作名称)。
【答案】2ClO3-+SO2 = 2ClO2+SO42- 稀释ClO2,防止爆炸 ClO2 防止温度过高NaClO2分解 过滤、洗涤、干燥
【解析】
由题给流程可知,酸化的氯酸钠溶液与二氧化硫反应生成硫酸钠、二氧化氯,反应中需同时鼓入空气的主要目的是防止发生反应产生的二氧化氯不稳定易分解爆炸,把它稀释至10%以下安全含量;二氧化氯在氢氧化钠溶液中与过氧化氢反应生成亚氯酸钠、氧气和水;将所得反应液减压蒸发、冷却结晶得到亚氯酸钠粗品。
(1)由题给流程可知,酸化的氯酸钠溶液与二氧化硫反应生成硫酸钠、二氧化氯和水,反应的离子方程式为2ClO3-+SO2 = 2ClO2+SO42-,反应中需同时鼓入空气的主要目的是防止发生反应产生的二氧化氯不稳定易分解爆炸,把它稀释至10%以下安全含量,故答案为:2ClO3-+SO2 = 2ClO2+SO42-;稀释ClO2,防止爆炸;
(2)合成过程中,二氧化氯中氯元素化合价降低被还原,二氧化氯做反应的氧化剂,过氧化氢做反应的还原剂,故答案为:ClO2;
(3)由题意可知,NaClO2高于60°C会分解,则蒸发时,需要减压防止温度过高NaClO2分解,故答案为:防止温度过高NaClO2分解;
(4)得NaClO,粗产品的操作是减压蒸发、冷却结晶、过滤、洗涤、干燥,故答案为:过滤、洗涤、干燥。

 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案【题目】下列有关叙述及相关解释均正确的是( )
选项 | 叙述 | 解释 |
A | 键的极性的强弱:N-H>O-H>F-H | 电负性:N<O<F |
B | 石墨的熔点高于金刚石 | 碳碳键的键长:石墨<金刚石 |
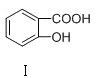
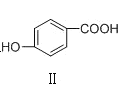
C | 熔点: | Ⅰ形成分子内氢键,Ⅱ形成分子间氢键 |
D | 酸性:HI>HBr>HCl | HI、HBr、HCl中的范德华力逐渐减小 |
A.AB.BC.CD.D
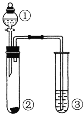
【题目】利用如图所示装置进行以下实验,能得到相应实验结论的是
① | ② | ③ | 实验结论 |
| |
A | 浓氨水 | NaOH | 酚酞 | NaOH的碱性比 NH3H2O的强 | |
B | 浓盐酸 | MnO2 | 淀粉溶液 | 非金属性:氯元素大于碘元素 | |
C | 浓硝酸 | Na2CO3 | Na2SiO3 | 酸性:HNO3 > H2CO3 > H2SiO3 | |
D | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
A.AB.BC.CD.D