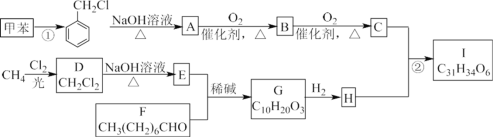
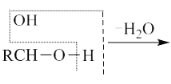
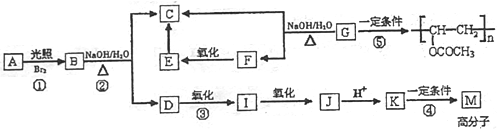
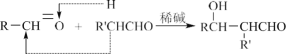题目内容
【题目】按如图所示装置进行下列不同的操作,请回答有关问题:操作:①只接通K1;②只接通K2;③只接通K3;④都断开。
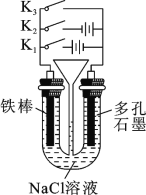
(1)铁棒的腐蚀速率由大到小的顺序是____(填操作序号)。
(2)原料粗盐中常含有泥沙和Ca2+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是_____(填序号)。
(3)若把U形管中的NaCl溶液换成100mL0.1mol/L的CuSO4溶液,且只进行操作②,则当电路中通过0.01mol电子时:(填“铁”或“石墨”)____电极增重_____g,此时溶液的pH=_____(忽略溶液体积变化)。
(4)若把U形管中的NaCl溶液换成加入了2molAgNO3、1molNa2SO4和1molBaCl2后的溶液,且只进行操作②,则装置中可观察到的现象为:____。通电一段时间后,氧化产物与还原产物的质量比为_____。
【答案】①>③>④>② ③①② 铁 0.32 1 两个电极上都产生气泡,U型管左右两边液面下降,产生的气体体积比约为2:1,漏斗中液面上升(或两个电极上都产生气泡,U型管左右两边液面下降,漏斗中液面上升) 8:1
【解析】
(1)铁腐蚀的速度由大到小的顺序是:作电解池阳极>原电池负极>不形成电池>电解池阴极;
(2)抓住除钡离子要放在除碳酸根离子前即可得到顺序关系;
(3)若把 U 形管中的 NaCl 溶液换成100mL0.1 mol/L 的 CuSO4溶液,且只进行操作②,得到电解池,Fe作阴极,氢离子得电子的还原反应,石墨碳棒作阳极,氢氧根离子失电子的氧化反应4OH--4e-=O2↑+2H2O,据电子守恒进行计算即可;
(4)把 U 形管中的 NaCl 溶液换成加入了2mol AgNO3、1mol Na2SO4 和 1mol BaCl2后的溶液,硫酸根离子和钡离子、氯离子和银离子之间反应得到沉淀,实际得到硝酸钠溶液,只进行操作②,相当于电解硝酸钠,实质是电解水,据电子守恒进行计算即可。
(1)只接通K1时,该装置是电解池,铁作阳极,腐蚀最快,只闭合K3时,该装置构成原电池,铁作负极发生吸氧腐蚀,腐蚀较快,只闭合K2时,该装置构成电解池,铁作阴极而被保护,所以铁腐蚀的速度由大到小的顺序是:只接通K1>只闭合K3>都断开>只闭合K2,即铁棒的腐蚀速率由大到小的顺序是①>③>④>②;
(2)应先加入过量BaCl2,除去SO42-,然后加过量Na2CO3,可除去Ca2+、Mg2+、Fe3+等,过滤后加入盐酸可除去Na2CO3,故试剂添加的合理顺序是③①②;
(3)若把U形管中的NaCl溶液换成100mL0.1mol/L的CuSO4溶液,且只进行操作②,得到电解池,Fe作阴极,铜离子得电子的还原反应Cu2++2e-=Cu,则当电路中通过0.01mol电子时,产生金属铜质量0.005mol×64g/mol=0.32g,石墨碳棒作阳极,氢氧根离子失电子的氧化反应4OH--4e-=O2↑+2H2O,则当电路中通过0.01mol电子时,消耗氢氧根离子是0.01mol,溶液氢离子是0.01mol,氢离子浓度为![]() =0.1mol/L,pH=1;
=0.1mol/L,pH=1;
(4)把U形管中的NaCl溶液换成加入了2molAgNO3、1molNa2SO4和1molBaCl2后的溶液,硫酸根离子和钡离子、氯离子和银离子之间反应得到沉淀,实际得到硝酸钠溶液,只进行操作②,相当于电解硝酸钠,实质是电解水,金属铁是阴极,氢离子得到电子产生氢气(还原产物),石墨电极是阳极,氢氧根失电子产生氧气(氧化产物),阴阳两极产生的气体体积比约为2:1,通电一段时间后,氧化产物与还原产物的质量比为8:1。

【题目】下列有关叙述及相关解释均正确的是( )
选项 | 叙述 | 解释 |
A | 键的极性的强弱:N-H>O-H>F-H | 电负性:N<O<F |
B | 石墨的熔点高于金刚石 | 碳碳键的键长:石墨<金刚石 |
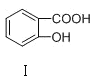
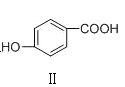
C | 熔点: | Ⅰ形成分子内氢键,Ⅱ形成分子间氢键 |
D | 酸性:HI>HBr>HCl | HI、HBr、HCl中的范德华力逐渐减小 |
A.AB.BC.CD.D