题目内容
【题目】4molL﹣1的KOH溶液100mL,取出5mL,这5mL溶液中K+浓度为( )
A.4 molL﹣1
B.0.2molL﹣1
C.2 molL﹣1
D.0.4 molL﹣1
【答案】A
【解析】解:4molL﹣1的KOH溶液中钾离子的物质的量浓度为4mol/L,从4molL﹣1的KOH溶液100mL中取出5mL,应用溶液具有均一性,则这5mL溶液中K+浓度为仍然为4mol/L,
故选A.

【题目】(1)1780年,意大利解剖学家伽伐尼在用银质手术刀触碰放在铁盘上的青蛙时,无意间发现青蛙腿部肌肉抽搐了一下,仿佛受到电流的刺激。伽伐尼认为出现这种现象的原因是动物体内存在“生物电”。结合你所学的知识模拟该过程,下列哪种材质的手术刀触碰铁盘上的青蛙腿不会产生触动_________(填字母)。
a、铝 b、玻璃 c、银 d、铁
(2)1799年,伏打仔细研究了伽伐尼的发现,以含食盐水的湿抹布,夹在银和锌的圆形版中间,堆积成圆柱状,制造出世界上最早的电池-伏打电池。将洁净的金属片A、B、D、E分别放置在浸有盐溶液的滤纸上面并压紧(如下图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
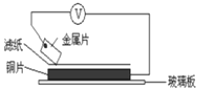
金属 | 电子流动方向 | 电压(V) |
A | A→Cu | +0.78 |
B | Cu→B | -0.15 |
D | D→Cu | +1.35 |
E | E→Cu | +0.30 |
已知:构成两电极的金属其金属活泼性相差越大,电压表的读数越大。请依据表中数据判断:_______金属可能是最强的还原剂;______金属一定不能从硫酸铜溶液中置换出铜。
(3)1836年,英国科学家丹尼尔对伏打电池进行改进,获得了世界上第一个具有稳定电流的电池,下图是丹尼尔电池的简易装置:
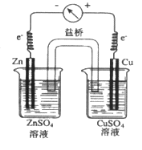
该电池的正极反应是_____________,负极反应 __________。
(4)随着社会的发展和科技的进步,越来越多的电池被制造出来。请选择适宜的材料和试剂设计一个原电池,使它的正极反应为:Fe3++e-=Fe2+以“![]() ”代表反应容器,“
”代表反应容器,“![]() ”代表导线,“
”代表导线,“![]() ”代表电极,“
”代表电极,“![]() ”代表小灯泡,
”代表小灯泡,
在下图方框内画出装置图并指出电极材料和电解质溶液,标出电源的正负极________。