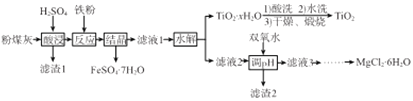
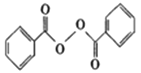
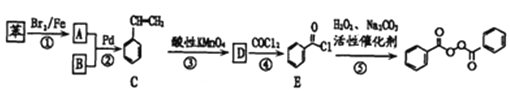
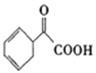
��Ŀ����
����Ŀ��50 mL 0.5 mol��L��1��������50 mL 0.55 mol��L��1��NaOH ��Һ����ͼ��ʾ��װ��(�������ȼ�)�н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ���ش��������⣺
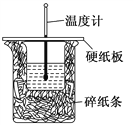
��1����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ�����Ʒ��______________��
��2���ձ���������ֽ����������___________________��
��3�����ձ����粻��Ӳֽ�壬��õ��к�����ֵ__________(����ƫ������ƫС������Ӱ����)��
��4��ʵ���и��� 60 mL 0.50 mol�� L��1������� 50 mL 0.55 mol�� L��1�� NaOH��Һ���з�Ӧ��������ʵ����ȣ����ų�������________(��������������������)�������к���________(��������������������)��
��5��ʵ���и��� 50mL 0.50 mol�� L��1�Ĵ���� 50 mL 0.55 mol�� L��1�� NaOH��Һ���з�Ӧ��������ʵ����ȣ������к���________(��������������������)����������______________________________��
���𰸡� ���β�������� ����ʵ������е�������ʧ ƫС ����� ��� ����� ���������Ҫ��������
��������(1).�������ȼƵĹ����֪����װ��ȱ�ٵIJ��������ǻ��β�����������ʴ�Ϊ�����β����������
(2).�к��Ȳⶨʵ��ɰܵĹؼ��DZ��¹�������С�ձ�֮��������ֽ�����Լ���ʵ������е�������ʧ���ʴ�Ϊ������ʵ������е�������ʧ��
(3).���ձ����粻��Ӳֽ�壬����һ��������ɢʧ����õ��к�����ֵ����ƫС���ʴ�Ϊ��ƫС��
(4).��Ӧ�ų����������������Լ�������Ķ����й�������60mL0.50molL1������Һ��50mL0.55molL1NaOH��Һ���з�Ӧ��������ʵ�����������ˮ�������������ų�������Ҳ���࣬�����к���ָ����ǿ���ǿ�Ӧ����1molˮʱ�ų�����������������������������60mL0.50molL1�������������Һ����ʵ�飬����к�����ֵ��ȣ��ʴ�Ϊ������ȣ���ȣ�
(5).���������ᣬ�������Ϊ���ȹ��̣������ô������������Һ��Ӧ���ų�����������ƫ�٣���õ��к��ȵ���ֵ��ƫС���ʴ�Ϊ������ȣ����������Ҫ����������