题目内容
【题目】将Fe2O3、Al2O3两种固体混合物溶于100mL稀硫酸中,向反应后的溶液中缓慢加入NaOH溶液,加入NaOH溶液的体积与生成沉淀的质量关系如图所示,试回答:
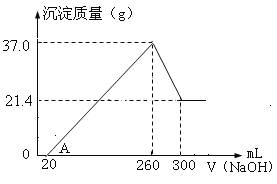
(1)原混合物中Fe2O3的质量是____________g。
(2)所用NaOH溶液物质的量浓度为___________。
(3)稀硫酸物质的量浓度为______________。
【答案】165 mol/L6.5 mol/L
【解析】
(1)由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明硫酸溶解氧化铝、氧化铁后硫酸有剩余,此时发生的反应为H2SO4+2NaOH=Na2SO4+2H2O,即最初加入的20mLNaOH溶液的作用是中和剩余的硫酸。从20mL~260mL氢氧化钠沉淀铁离子和铝离子,从260mL~300mL,NaOH溶解氢氧化铝,发生反应NaOH+Al(OH)3=NaAlO2+2H2O,这说明最终得到的21.4g沉淀是氢氧化铁的质量,氢氧化铁的物质的量是21.4g÷107g/mol=0.2mol,根据铁元素守恒可知氧化铁的物质的量是0.1mol,质量是0.1mol×160g/mol=16g;
(2)从260mL~300mL,NaOH溶解氢氧化铝,发生反应NaOH+Al(OH)3=NaAlO2+2H2O,氢氧化铝的质量是37g-21.4g=15.6g,物质的量是15.6g÷78g/mol=0.2mol,消耗NaOH为0.2mol,所以氢氧化钠的浓度为0.2mol÷0.04L=5mol/L;
(3)当V(NaOH溶液)=260mL时,沉淀量最大,此时为Fe(OH)3和Al(OH)3,溶液中溶质为Na2SO4,根据钠元素守恒2n(Na2SO4)=n(NaOH),故n(Na2SO4)=0.5×0.26L×5mol/L=0.65mol,根据硫酸根守恒n(H2SO4)=n(Na2SO4)=0.65mol,则c(H2SO4)=0.65mol÷0.1L=6.5mol/L。