题目内容
【题目】(I)某原料经测定主要含有A、B、C、D四种原子序数依次增大的短周期元素,其相关信息如下:
元素 | 元素性质或原子结构 |
A | 周期表中原子半径最小的元素 |
B | 原子核外有三种不同的能级且各个能级所填充的电子数相同 |
C | 最外层p轨道半充满 |
D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
请回答下列问题(用A、B、C、D、所对应的元素符号作答):
(1) B、C、D第一电离能由大到小的顺序为__________________________________
(2)![]() 常用作除锈剂,该分子中B的杂化方式为_____;1 mol
常用作除锈剂,该分子中B的杂化方式为_____;1 mol ![]() 分子中含有σ键与π键的数目之比为_____。
分子中含有σ键与π键的数目之比为_____。
(3) ![]() 分子中均含有18个电子,它们的沸点相差较大,主要原因是_____________________
分子中均含有18个电子,它们的沸点相差较大,主要原因是_____________________
(Ⅱ)化学与生活密切相关。K2Cr2O7曾用于检测司机是否酒后驾驶:Cr2O![]() (橙色)+CH3CH2OH
(橙色)+CH3CH2OH![]() Cr3+(绿色)+CH3COOH (未配平)
Cr3+(绿色)+CH3COOH (未配平)
(4)基态Cr 原子的价电子排布图为__________________________________
(5)已知Cr3+等过渡元素水合离子的颜色如下表所示:
离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因为________________。
(6)ZnCl2浓溶液常用于除去金属表面的氧化物,例如与FeO反应可得Fe[Zn(OH)Cl2]2溶液。Fe[Zn(OH)Cl2]2的水溶液中不存在的粒子间作用力有____________(填选项字母);
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力 F.氢键
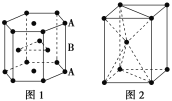
(7)锌是人体必需的微量元素之一,其堆积方式如图1,晶胞结构如图2。锌的堆积方式为_____________________,配位数为_______。
【答案】N>O>C ![]() 7:2
7:2 ![]() 分子间形成氢键
分子间形成氢键  根据离子的核外电子排布可判断由于d轨道上没有未成对电子(3d轨道上电子为全空或全满),所以Sc3+、Zn2+的水合离子为无色。 AC 六方最密堆积 12
根据离子的核外电子排布可判断由于d轨道上没有未成对电子(3d轨道上电子为全空或全满),所以Sc3+、Zn2+的水合离子为无色。 AC 六方最密堆积 12
【解析】
Ⅰ.根据题干信息,A是元素周期表中原子半径最小的元素,则A为H元素,B的原子核外有三种不同的能级且各个能级所填充的电子数相同,则B为C元素,C的最外层p轨道半充满,则C为N元素,D位于短周期,其原子的核外成对电子数是未成对电子数的3倍,则D为O元素,据此分析解答;
Ⅱ.根据核外电子排布规律书写电子排布图,由配合物结构分析配合物中粒子间的作用力,根据均摊法得出原子配位数。
Ⅰ.(1)由上述分析可知,B、C、D分别为C、N、O,由于N原子的最外层p轨道半充满,所以N的第一电离能最大,O原子的半径小于C原子,则第一电离能N>O>C;
(2)A2B2D4为H2C2O4,其结构式为![]() ,分子中C原子的杂化方式为sp2,1molH2C2O4分子中含有7molσ键与2molπ键,数目之比为7:2;
,分子中C原子的杂化方式为sp2,1molH2C2O4分子中含有7molσ键与2molπ键,数目之比为7:2;
(3)N2H4分子间可形成氢键,因此其沸点高于C2H6;
Ⅱ.(4)基态Cr原子核外有24个电子,其核外电子排布式为[Ar]3d54s1,则其价电子排布图为 ;
;
(5)根据离子的核外电子排布可判断,由于Sc3+、Zn2+的d轨道上没有未成对电子(3d轨道上电子为全空或全满),所以Sc3+、Zn2+的水合离子为无色;
(6)Fe2+与[Zn(OH)Cl2]-之间虽然形成离子键,在溶液中发生电离以离子形式存在,离子键被破坏,所以[Fe[Zn(OH)Cl2]2的水溶液中以离子形式存在,没有离子键,Fe[Zn(OH)Cl2]2是配合物,存在配位键、共价键,水分子间还有范德华力和氢键,故Fe[Zn(OH)Cl2]2的水溶液中不存在的粒子间作用力有离子键和金属键,答案选AC;
(7)根据Zn的堆积方式可知,Zn的堆积方式为六方最密堆积,六方最密堆积的配位数为12。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案