题目内容
(16分) A、B、C、D、E、F是元素周期表中六种短周期元素,请根据表中信息回答下列问题
|
元素 |
A |
B |
C |
D |
E |
F |
|
性质或结构 信息 |
形成化合物种类最多的元素 |
最高正价是最低负价绝对值的3倍 |
族序数等于周期数的3倍 |
周期数是族序数的3倍 |
地壳中含量最高的金属元素 |
最高价氧化物对应水化物是最强的含氧酸 |
(1)元素B 的离子结构示意图 元素F的最高价氧化物的化学式为 。
(2)元素A、D分别与元素C 形成原子个数比为1:2的化合物甲和1:1 的化合物乙,则甲属于 分子(填“极性”或“非极性”),化合物乙的电子式 ,甲与乙反应的化学方程式为 。
(3)元素B、D组成化合物丙,其晶体类型为 ,化合物丙的溶液呈 (填“酸性”“碱性”或“中性”)。
(4)元素A与氢元素组成的最简单的化合物丁是一种优质燃料,燃烧热值高。
①实验测得,在常温常压下,1g化合物丁完全燃烧生成液态水,放出55.65 kJ 热量。则表示化合物丁的燃烧热的热化学方程式为 。
②某实验小组依据丁燃烧的反应原理,设计如右图所示的电池装置。

a.该电池正极的电极反应为 。
b.工作一段时间后,测得溶液的pH减小,该电池总反应的离子方程式为 。
(5)G也是短周期元素,其核外电子层数与最外层电子数相等,且与E处于元素周期表中对角线位置,它们的单质及其化合物的性质相似,写出G的氧化物与NaOH溶液反应的离子方程式: 。若E的氯化物熔沸点较低、易升华,则E的氯化物是 化合物(填“离子”或“共价”),试设计一个简单实验证明你的选择 。
(1)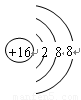 (1分)
Cl2O7 (1分)
(1分)
Cl2O7 (1分)
(2)非极性 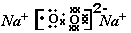 , 2CO2 + 2Na2O2
= 2Na2CO3 +O2
, 2CO2 + 2Na2O2
= 2Na2CO3 +O2
(各1分,3分)
(3)离子晶体 ,碱性(各1分)
(4)① CH4(g) + 2O2 (g) = CO2(g) + 2H2O(l) ;ΔH=890.4KJ/mol (2分)
② a、O2 + 2H2O + 4e- = 4OH- (1分)
b、CH4 + 2O2 + 2OH- = CO32- + 3H2O (1分)
(5)BeO + 2OH- = BeO22- + H2O (2分)共价 (1分)
将其加热到熔融状态,做导电性实验,看其能否导电 (2分)
【解析】

 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.