题目内容
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入5 mol·L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如图所示。则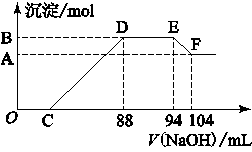
(1)B与A的差值为________mol;
(2)原硝酸溶液中含硝酸的物质的量为________mol;
(3)铝粉和铁粉的混合物中铝粉与铁粉的物质的量之比为________;
(4)写出铝与该浓度硝酸反应的离子方程式____________。
(1)0.05 (2) 0.5 (3) 5∶3 (4) 8Al+30H++3NO3-=8Al3++3NH4++9H2O
解析试题分析:铝粉和铁粉的混合物与一定量很稀HNO3充分反应,被氧化为Al3+、Fe3+,通过题意,反应始终没有气体生成,可以得出不会有氮的氧化物生成,又有硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,可以推测N元素由+5变成了-3价,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后,由图知继续加入氢氧化钠溶液,沉淀量不变,可得与NH4+发生了反应,则随着NaOH的滴加,发生的反应依次有:①H++OH-=H2O,②Fe3++3OH-=Fe(OH)3↓,Al3++3OH-=Al(OH)3↓,③NH4++OH-═NH3?H2O,④Al(OH)3 +OH-=AlO2-+2H2O。由上述分析可知,溶液中的阳离子有Al3+、Fe3+、NH4+、H+。(1)由图可知,EF段消耗的氢氧化钠溶液为104mL-94m=10mL,故该计算参加反应的氢氧化钠为0.01L×5mol/L=0.05mol,根据Al(OH)3 +OH-=AlO2-+2H2O可知,Al(OH)3的物质的量为0.05mol,故答案为:0.05mol;(2)由上述分析可知,DE段为铵根离子与氢氧根离子反应生成一水合氨,反应离子方程式为:NH4++OH-═NH3?H2O,由图可知,DE段消耗的氢氧化钠的体积为94mL-88m=6mL,故该阶段参加反应的氢氧化钠为0.006L×5mol/L=0.03mol,根据NH4++OH-═NH3?H2O 可知,计算溶液中n(NH4+)=0.03mol,根据(3)中计算可知n[Al(OH)3]=0.05mol,根据铝元素守恒,故混合金属中n(Al)=0.05mol,根据电子转移守恒有,3n(Fe)+3n(Al)=8n(NH4+),即3n(Fe)+3×0.05mol=8×0.03mol,解得n(Fe)=0.03mol,故原混合物中铝粉与铁粉的物质的量之比为0.05mol:0.03mol=5:3,故答案为:1:3;由反应过程可知,到加入氢氧化钠为88mL时,溶液中溶质为硝酸钠与硝酸铵,根据钠元素守恒,可知n(NaNO3)=n(NaOH)=0.088L×5mol/L=0.44mol,根据(4)的计算可知n(NH4NO3)=n(NH4+)=0.03mol,根据氮元素守恒计算原硝酸溶液中n(HNO3)=n(NaNO3)+2n(NH4NO3)=0.44mol+0.03mol×2=0.5mol,故答案为:0.5。
考点:本题考查金属与硝酸的反应、离子方程式的书写、氧化还原反应、化学计算等知识点,难度较大,清楚图中各阶段反应过程,据此判断出硝酸的还原产物以及电子转移守恒的运用是解题关键。

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案实验室中需要配制500 mL 0.10 mol·L-1的NaOH溶液,就该实验回答下列问题。
(1)用托盘天平称量NaOH固态 g。称量NaOH固体需注意以下两个问题:①因为NaOH具有腐蚀性,所以称量时,应选用 盛装NaOH固体;②称量必须迅速,目的是防止 。
(2)实验所需要的仪器除托盘天平、药匙外,还需要的玻璃仪器有: 、 、 、 。
(3)下列操作对所配制的溶液浓度没有影响的是 。
| A.定容时仰视刻度线 |
| B.将烧杯中溶解后的溶液立刻注入容量瓶,然后再添加蒸馏水至刻度线 |
| C.摇匀定容后,用胶头滴管向容量瓶中滴加蒸馏水至刻度线 |
| D.配制溶液前用蒸馏水润洗容量瓶 |

 H2(g)+1/2S2(g) 在恒容密闭容器中,控制不同温度进行H2S的分解实验:以H2S的起始浓度均为c mol·L-1测定H2S的转化率,结果如右下图所示。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则反应速率v(H2)= (用含c、t的代数式表示)。请说明随温度的升高,曲线b向曲线a逼近的原因: 。
H2(g)+1/2S2(g) 在恒容密闭容器中,控制不同温度进行H2S的分解实验:以H2S的起始浓度均为c mol·L-1测定H2S的转化率,结果如右下图所示。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则反应速率v(H2)= (用含c、t的代数式表示)。请说明随温度的升高,曲线b向曲线a逼近的原因: 。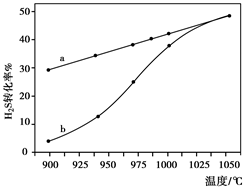
 2CuSO4+2H2O。现欲将6.4 g铜完全溶解,加水后得200 mL溶液。计算:
2CuSO4+2H2O。现欲将6.4 g铜完全溶解,加水后得200 mL溶液。计算: 