题目内容
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为__________mol·L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_______。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(4)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取________mL上述浓盐酸进行配制。(保留小数点后1位)
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填“偏大”、“偏小”或“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面。( )
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水。( )
(5)①假设该同学成功配制了0.400 mol·L-1的盐酸,他又用该盐酸中和含0.4 g NaOH的NaOH溶液,则该同学需取________mL盐酸。
②假设该同学用新配制的盐酸中和含0.4 g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是________。
A.浓盐酸挥发,浓度不足 B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
(1)11.9 (2分) (2)BD (2分) (3) B、C、D(2分,)
(4)①16.8(2分) ②a.偏小(2分) b.偏小(2分)
(5)①25(2分) ②C(2分)
解析试题分析:(1)设盐酸体积为1L,c(HCl)=1L×1000×1.19g/L×36.5%÷36.5g/mol÷1L=11.9mol?L?1。
(2)溶液中HCl的物质的量、溶液中Cl-的数目随所取体积的多少而变化,溶液的浓度、溶液的密度不随所取体积的多少而变化,故正确答案为BD。
(3)A、使用容量瓶前要检验是否漏水,正确;B、容量瓶不需要润洗,错误;C、称量的溶质应在烧杯中溶解,冷却后再转移至容量瓶中,错误;D、量取的液体也要在烧杯中溶解,错误;E、定容后,,盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀,正确。
(4)①设需要的浓盐酸的体积为VL,则0.5L×0.400mol?L?1=V×11.9mol?L?1,可得V=0.0168L=16.8mL。
②a用量筒量取浓盐酸时俯视观察凹液面,造成所取浓盐酸的体积偏小,故配制的稀盐酸浓度偏小;b定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水,造成溶液的体积偏大,故配制的稀盐酸浓度偏小。
(5)①HCl与NaOH反应,物质的量之比为1:1,所以V(HCl)=0.4g÷40g/mol÷0.400mol?L?1=0.025L=25mL。
②所以盐酸体积偏小,说明配制的盐酸浓度偏大。A、浓盐酸挥发,造成配制的盐酸浓度偏小,不符合要求;B、配制溶液时,未洗涤烧杯,造成配制的盐酸浓度偏小,不符合要求;C、配制溶液时,俯视容量瓶刻度线,造成配制的溶液体积偏小,浓度偏大,正确;D、加水时超过刻度线,用胶头滴管吸出,造成配制的溶液体积偏大,浓度偏小,不符合题意。
考点:本题考查一定物质的量浓度溶液的配制和计算、误差分析。

(1)下列物质中,物质的量最大的是________,含原子个数最多的是________,质量最大的是________。
| A.3gH2; | B.标况下33.6LCO2; | C.1.204×1024个HCl分子; | D.49gH2SO4;E.46g乙醇(C2H5OH);F.4℃时10mL水 |
实验室需要0.80 mol·L-1 NaOH溶液475 mL 和0. 40 mol·L-1硫酸500 mL。根据这两种溶液的配制情况回答下列问题: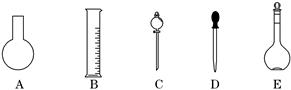
(1)如图所示的仪器中配制溶液肯定不需要的是__________(填编号),配制上述溶液还需用到的玻璃仪器是__________(填仪器名称)。
(2)容量瓶所不具备的功能有__________(填编号)。
| A.配制一定体积准确浓度的标准溶液 |
| B.量取一定体积的液体 |
| C.测量容量瓶规格以下的任意体积的液体 |
| D.贮存溶液 |
(3)根据计算用托盘天平称取NaOH的质量为________g。在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度__________0.80 mol·L-1(填“大于”、“小于”或“等于”,下同)。若还未等溶液冷却就定容了,则所得溶液浓度____________0.80 mol·L-1。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数)。如果实验室有10 mL、15 mL、20 mL、50 mL的量筒,最好选用________mL的量筒。