题目内容
2.将amLNO、bmLNO2和cmLO2混合于同一试管中,将试管倒置于水中,充分反应后,试管内气体全部消失,则a:b:c不可能是( )| A. | 1:1:1 | B. | 2:1:1 | C. | 3:7:4 | D. | 1:5:2 |
分析 若气体能完全溶于水,即NO、NO2、O2三种气体恰好完全反应,全部生成了硝酸,根据反应中电子得失守恒,应该有n(NO)×3+n(NO2)=n(O2)×4,根据气体的体积之比等于物质的量之比来计算回答.
解答 解:若气体能完全溶于水,即NO、NO2、O2三种气体恰好完全反应,全部生成了硝酸,
假设气体的物质的量是amolNO,bmolNO2和cmolO2,
反应中amolNO失去3amol电子,bmolNO2失去bmol电子,cmolO2得到4cmol电子生成HNO3,
根据反应中电子得失守恒可得:3a+b=4c成立,
各选项中B的数据不能使关系式成立,
故选B.
点评 本题主要考查了氧化还原反应规律的应用,题目难度不大,明确氧化还原反应中电子得失守恒是解题的关键,试题侧重考查学生分析能力和计算能力.

练习册系列答案
相关题目
12.在一定温度下,体积不变的密闭容器中可逆反应A(g)+3B(g)?2C(g) 达到平衡的标志是( )
| A. | 气体的密度不再变化 | |
| B. | A、B、C的浓度之比为1:3:2 | |
| C. | A、B、C的浓度不再变化 | |
| D. | 单位时间内生成n molA,同时生成3n molB |
17.已知下列元素的原子半径如表所示,根据以下数据,磷原子半径可能是( )
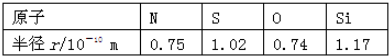

| A. | 0.70×10-10m | B. | 0.80×10-10m | C. | 1.10×10-10m | D. | 1.20×10-10m |
7.下列化合物,按其晶体的熔点由高到低排列正确的是( )
| A. | CsCl、SiO2、CBr4、CF4 | B. | SiO2、CsCl、CF4、CBr4 | ||
| C. | SiO2、CsCl、CBr4、CF4 | D. | CF4、CBr4、CsCl、SiO2 |
14.下列变化或应用中,与分子间作用力有关的是( )
| A. | 臭氧转变为氧气 | |
| B. | 工业生产中氯化钠晶体的熔化、冷却 | |
| C. | 夏天马路洒水降温 | |
| D. | 日本大地震中用次氯酸溶液进行环境消毒 |
11.盛有氯化钡稀溶液的甲乙两试管分别通入SO2至饱和,若向甲试管中加入足量氯水,乙试管中加入足量氢氧化钠溶液,则下列叙述正确的是( )
| A. | 甲、乙两试管都有白色沉淀生成 | B. | 甲、乙两管都没有白色沉淀生成 | ||
| C. | 甲管没有白色沉淀生成而乙试管有 | D. | 甲管有白色沉淀而乙试管没有 |
12.目前,科学界拟合成一种“双重结构”的球形分子,即把足球烯C60的分子容纳在Si60分子中,外面的硅原子与里面的碳原子以共价键结合,下列叙述错误的是( )
| A. | 该晶体为原子晶体 | B. | 该物质的熔沸点较低 | ||
| C. | 该物质是新化合物 | D. | 该物质的相对分子量质量为2400 |
 日常生活中,我们经常饮用矿泉水.如图是某饮用天然水部分商标图,图中列出了理化指标.我据此回答:这里的钙、镁、钾、钠指的是( )
日常生活中,我们经常饮用矿泉水.如图是某饮用天然水部分商标图,图中列出了理化指标.我据此回答:这里的钙、镁、钾、钠指的是( )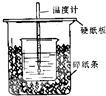 用50mL0.50mol/L盐酸与50mL0.55mol/L氢氧化钠溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/L氢氧化钠溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: