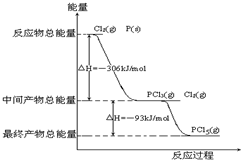
题目内容
7.下列化合物,按其晶体的熔点由高到低排列正确的是( )| A. | CsCl、SiO2、CBr4、CF4 | B. | SiO2、CsCl、CF4、CBr4 | ||
| C. | SiO2、CsCl、CBr4、CF4 | D. | CF4、CBr4、CsCl、SiO2 |
分析 晶体熔沸点高低顺序是:原子晶体>离子晶体>分子晶体,分子晶体熔沸点与相对分子质量成正比,还与氢键有关,含有氢键的氢化物熔沸点较高,据此分析解答.
解答 解:晶体熔沸点高低顺序是:原子晶体>离子晶体>分子晶体,分子晶体熔沸点与相对分子质量成正比,还与氢键有关,含有氢键的氢化物熔沸点较高,SiO2、CsCl、CBr4、CF4晶体类型分别是原子晶体、离子晶体、分子晶体、分子晶体,但CBr4的相对分子质量大于CF4,所以这几种物质熔沸点高低顺序是SiO2、CsCl、CBr4、CF4,故选C.
点评 本题考查晶体熔沸点高低比较,为高频考点,侧重考查晶体类型判断,明确常见物质晶体类型及晶体与熔沸点关系即可解答,注意分子晶体中分子稳定性与化学键有关,但分子晶体熔沸点与分子间作用力和氢键有关,为易错点.

练习册系列答案
相关题目
17.核电荷数小于18的某元素X,其原子核外电子层数为a,最外层电子数为(2a+1).下列有关元素X的说法中,不正确的是( )
| A. | 元素X的原子核内质子数可能为(2a2-1) | |
| B. | 元素X形成的单质既能作氧化剂又能作还原剂 | |
| C. | 元素X形成的简单离子,各电子层的电子数均达到2n2个(n表示电子层数) | |
| D. | 由元素X形成的某些化合物,可能具有杀菌消毒的作用 |
18.应用Na2CO3和NaHCO3的下列性质设计实验,不能够鉴别Na2CO3和NaHCO3固体的是( )
| A. | 水溶性 | B. | 热稳定性 | C. | 与酸反应 | D. | 焰色反应 |
2.将amLNO、bmLNO2和cmLO2混合于同一试管中,将试管倒置于水中,充分反应后,试管内气体全部消失,则a:b:c不可能是( )
| A. | 1:1:1 | B. | 2:1:1 | C. | 3:7:4 | D. | 1:5:2 |
12.某主族元素R的原子其电子式可用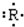 表示.该元素组成的以下物质,其分子式肯定错误的是( )
表示.该元素组成的以下物质,其分子式肯定错误的是( )
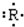 表示.该元素组成的以下物质,其分子式肯定错误的是( )
表示.该元素组成的以下物质,其分子式肯定错误的是( )| A. | 最高价氧化物分子式为R2O5 | B. | 含氧酸分子式为 HRO3 | ||
| C. | 含氧酸分子式为H3RO4 | D. | 气态氢化物分子式为RH5 |
19.表中列出了前20号元素中的某些元素性质的有关数据:
试回答下列问题:
(1)以上10种元素的原子中,最容易失去电子的是②(填写编号);与H2最容易化合的非金属单质是氟气(写物质名称).
(2)写出元素⑤的氢化物结构式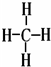 ;③和⑤形成的化合物的电子式
;③和⑤形成的化合物的电子式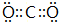 ;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式
;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式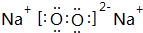 ;
;
(3)某元素R的原子半径为1.02×10-10m,该元素在周期表中位于第三周期第ⅥA族,请画出它的阴离子结构示意图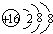 ,比较R的阴离子与②的阳离子半径大小(写离子符号)S2->K+
,比较R的阴离子与②的阳离子半径大小(写离子符号)S2->K+
(4)写出上述⑥、⑦两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的一种物质的分子式PCl3.
(5)写出④的最高价氧化物的水化物分别跟⑦和⑧的最高价氧化物的水化物反应的离子方程式3H++Al(OH)3=Al3++3H2O;OH-+Al(OH)3=AlO2-+2H2O.
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径 (10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |
(1)以上10种元素的原子中,最容易失去电子的是②(填写编号);与H2最容易化合的非金属单质是氟气(写物质名称).
(2)写出元素⑤的氢化物结构式
 ;③和⑤形成的化合物的电子式
;③和⑤形成的化合物的电子式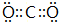 ;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式
;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式 ;
;(3)某元素R的原子半径为1.02×10-10m,该元素在周期表中位于第三周期第ⅥA族,请画出它的阴离子结构示意图
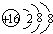 ,比较R的阴离子与②的阳离子半径大小(写离子符号)S2->K+
,比较R的阴离子与②的阳离子半径大小(写离子符号)S2->K+(4)写出上述⑥、⑦两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的一种物质的分子式PCl3.
(5)写出④的最高价氧化物的水化物分别跟⑦和⑧的最高价氧化物的水化物反应的离子方程式3H++Al(OH)3=Al3++3H2O;OH-+Al(OH)3=AlO2-+2H2O.
16.A、B、C、D、E五种元素的原子的原子序数都小于18,且具有相同的电子层,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序( )
| A. | B、A、D、C、E | B. | C、D、B、A、E | C. | B、A、C、D、E | D. | C、D、A、B、E |