题目内容
17.已知下列元素的原子半径如表所示,根据以下数据,磷原子半径可能是( )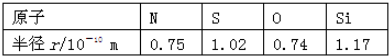
| A. | 0.70×10-10m | B. | 0.80×10-10m | C. | 1.10×10-10m | D. | 1.20×10-10m |
分析 同周期自左而右原子半径减小,同主族自上而下原子半径增大,据此判断.
解答 解:同周期自左而右原子半径减小,同主族自上而下原子半径增大,P原子半径应介于S与Si原子半径之间,故其原子半径可能为1.10×10-10 m,故选C.
点评 本题考查原子半径比较,难度不大,注意对元素周期律的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.苯在催化剂存在下与液溴反应,而苯酚与溴水即反应,原因( )
| A. | 苯环与羟基相互影响,使苯环上氢原子活泼了 | |
| B. | 苯环与羟基相互影响,使羟基上的氢原子活泼了 | |
| C. | 苯环影响羟基,使羟基上的氢原子活泼了 | |
| D. | 羟基影响苯环,使苯环上的某些氢原子活泼了 |
5.试写出中学阶段常见的两种制取氧气的化学方程式:H2O2$\frac{\underline{\;MnO_2\;}}{\;}$H2O+O2↑;2Na2O2+2H2O=4NaOH+O2↑.
Ⅱ.实验室中通常用MnO2作催化剂分解过氧化氢,已知CuSO4溶液对过氧化氢的分解也具有催化作用,某实验兴趣小组同学猜想其他盐溶液也可能在这个反应中起同样的作用,于是他们做了以下探究.请你帮助他们完成实验报告:
(1)实验过程:在一支试管中加入5mL 5%的H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管.
实验现象:试管中有大量的气泡产生,带火星的木条复燃.
实验结论:FeCl3溶液可以催化分解H2O2.
(2)已知FeCl3在水中可解离出Fe3+和Cl-,同学们提出以下猜想:
甲同学的猜想:真正催化分解H2O2的是FeCl3溶液中的H2O;
乙同学的猜想:真正催化分解H2O2的是FeCl3溶液中的Fe3+;
丙同学的猜想:真正催化分解H2O2的是FeCl3溶液中的Cl-.
你认为最不可能的是甲同学的猜想,理由是因过氧化氢溶液中自身有水,可见水不是催化剂.
(3)同学们对余下的两个猜想,用实验进行了探究,并记录如下,请你仔细分析后填表:
实验过程实验现象结论
Ⅱ.实验室中通常用MnO2作催化剂分解过氧化氢,已知CuSO4溶液对过氧化氢的分解也具有催化作用,某实验兴趣小组同学猜想其他盐溶液也可能在这个反应中起同样的作用,于是他们做了以下探究.请你帮助他们完成实验报告:
(1)实验过程:在一支试管中加入5mL 5%的H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管.
实验现象:试管中有大量的气泡产生,带火星的木条复燃.
实验结论:FeCl3溶液可以催化分解H2O2.
(2)已知FeCl3在水中可解离出Fe3+和Cl-,同学们提出以下猜想:
甲同学的猜想:真正催化分解H2O2的是FeCl3溶液中的H2O;
乙同学的猜想:真正催化分解H2O2的是FeCl3溶液中的Fe3+;
丙同学的猜想:真正催化分解H2O2的是FeCl3溶液中的Cl-.
你认为最不可能的是甲同学的猜想,理由是因过氧化氢溶液中自身有水,可见水不是催化剂.
(3)同学们对余下的两个猜想,用实验进行了探究,并记录如下,请你仔细分析后填表:
实验过程实验现象结论
| 实验过程 | 实验现象 | 结论 |
| 向盛有5mL 5%的H2O2溶液的试管中滴入少量的 HCl,把带火星的木条伸入试管. | 无明显现象 | 起催化作用的 不是Cl- |
| 向盛有5mL 5%的H2O2溶液的试管中滴入少量的Fe2(SO4)3,把带火星的木条伸入试管. | 试管中有大量气泡产生,带火星的木条复燃. | 起催化作用的 是Fe3+ |
12.在一定温度下,反应2NO2N?N2O4在一定体积中达平衡的标志是( )
| A. | 混合气颜色不随时间的变化 | |
| B. | 数值上v(NO2生成)=2v(N2O4消耗) | |
| C. | 单位时间内反应物减少的分子数等于生成物增加的分子数 | |
| D. | 密度不随时间的变化而变化 |
2.将amLNO、bmLNO2和cmLO2混合于同一试管中,将试管倒置于水中,充分反应后,试管内气体全部消失,则a:b:c不可能是( )
| A. | 1:1:1 | B. | 2:1:1 | C. | 3:7:4 | D. | 1:5:2 |
9.下列X溶液均能跟盐酸反应,其中反应速率最快的是( )
| A. | 10℃时20mL、3mol•L-1的X溶液 | B. | 20℃时30mL、2mol•L-1的X溶液 | ||
| C. | 10℃时40mL、2mol•L-1的X溶液 | D. | 20℃时10mL、4mol•L-1的X溶液 |
6.常温下,0.1mol•L-1某一元酸(HA)溶液中$\frac{{c(O{H^-})}}{{c({H^+})}}$=1×10-6,下列叙述正确的是( )
| A. | 加水稀释,溶液的c(OH-)增大 | |
| B. | 此时,HA的电离平衡常数约为10-8 | |
| C. | 溶液中水电离出的H+的物质的量浓度约为10-10mol•L-1 | |
| D. | 与0.05 mol•L-1NaOH溶液等体积混合后所得溶液中离子浓度大小关系为c(A-)>c(Na+)>c(OH-)>c(H+) |
7.现在家用的燃料一般有柴禾、煤、液化石油气、天然气等.其中天然气的主要成分是( )
| A. | H2 | B. | CH4 | C. | C5H12 | D. | CO |