题目内容
【题目】铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒。工业上往往采取下列循环工艺防止铬的污染:
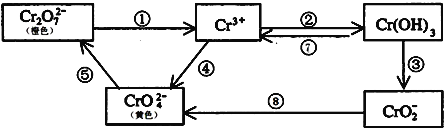
完成下列填空:
(1)含Cr2O72-离子的废水在酸性条件下用Fe3O4处理,反应的离子方程式如下,配平该离子反应方程式:
_____Cr2O72-+Fe3O4+H+→Cr3++Fe3++H2O
(2)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水。写出电极反应:阳极_____________________ 阴极_______________________;用铁做阳极的目的是:_____________________
(3)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式:______________________
(4)已知Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,首先生成的沉淀是__________
(5)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:① Cr2O72- +6I- + 14H+ →3I2 + 2Cr3+ + 7H2O ② 2S2O32- + I2→S4O62- + 2I- ,准确称取纯净的K2Cr2O7 0.294g ,配成溶液,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。则Na2S2O3溶液的物质的量浓度为_____________________(保留四位有效数字)。
【答案】 1,6,62,2,18,31 Fe-2e-=Fe2+ 2H++2e-=H2↑ 让铁失去电子,生成Fe2+,提供还原剂,以便将Cr2O72-还原成Cr3+ 2CrO42-+2H+![]() Cr2O72-+H2O AgCl 0.2400mol·L-1
Cr2O72-+H2O AgCl 0.2400mol·L-1
【解析】(1)用化合价升降法配平,Cr2O72-中的2个Cr化合价共降低6,每个Fe3O4中有1个+2价Fe升高到+3,升高了1,所以给Fe3O4配上6;根据电荷守恒和质量守恒、用观察法配平其余项,该离子反应方程式为Cr2O72-+6Fe3O4+62H+=2Cr3++18Fe3++31H2O .
(2)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水。阳极发生的是氧化反应,电极反应为Fe-2e-=Fe2+;阴极发生的是还原反应,电极反应为2H++2e-=H2↑;用铁做阳极的目的是让铁失去电子生成Fe2+,提供还原剂,以便将Cr2O72-还原成Cr3+ 。
(3)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色, CrO42-变为Cr2O72-,该反应的离子方程式为2CrO42-+2H+![]() Cr2O72-+H2O 。
Cr2O72-+H2O 。
(4)已知Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,假设两溶液的物质的量浓度均为c,则由Ag2CrO4的Ksp 9.0×10-12可求出Ag2CrO4沉淀所需的最小浓度c(Ag+)=![]() mol/L;由AgCl的Ksp 1.56×10-10,求出AgCl沉淀所需的最小浓度c(Ag+)=
mol/L;由AgCl的Ksp 1.56×10-10,求出AgCl沉淀所需的最小浓度c(Ag+)=![]() ,显然,AgCl沉淀所需的c(Ag+)更小,所以首先生成的沉淀是AgCl 。
,显然,AgCl沉淀所需的c(Ag+)更小,所以首先生成的沉淀是AgCl 。
(5)由测定Na2S2O3溶液的物质的量浓度的两个反应:① Cr2O72- +6I- + 14H+ →3I2 + 2Cr3+ + 7H2O ② 2S2O32- + I2→S4O62- + 2I- ,可以得到关系式:Cr2O72- ~ 3I2 ~6S2O32-。0.294g K2Cr2O7 的物质的量为n(K2Cr2O7)=0.001mol ,所以n(Na2S2O3)=6 n(K2Cr2O7)=0.006mol,消耗Na2S2O3溶液25.00mL,则Na2S2O3溶液的物质的量浓度为![]() 0.2400mol·L-1。
0.2400mol·L-1。

【题目】我们穿的衣服通常是由纤维织成的,常见的纤维有棉花、羊毛、涤纶等。用灼烧法可初步鉴别三种纤维,给三种纤维编号后,分别灼烧产生的气味如下:
纤维编号 | ① | ② | ③ |
灼烧时的气味 | 特殊气味 | 烧纸气味 | 烧焦羽毛气味 |
则羊毛的编号为_________,棉花的编号为_________,涤纶的编号为_________。



