题目内容
【题目】Ⅰ.甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源。
(1)101 kPa时,1 mol CH3OH液体完全燃烧生成CO2和液态水时放出热量726.51 kJ,则表示甲醇燃烧的热化学方程式为_______________________________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1=+49.0 kJ·mol-1 ②CH3OH(g)+ ![]() O2(g)= CO2(g)+2H2(g) △H2
O2(g)= CO2(g)+2H2(g) △H2
已知H2(g)+ ![]() O2(g)===H2O(g) △H = —241.8kJ·mol-1,则反应②的△H2=_____________。
O2(g)===H2O(g) △H = —241.8kJ·mol-1,则反应②的△H2=_____________。
(3)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)![]() CH3OH(g),现在实验室模拟该反应并进行分析。下图是该反应在不同温度下CO的转化率随时间变化的曲线如右图。
CH3OH(g),现在实验室模拟该反应并进行分析。下图是该反应在不同温度下CO的转化率随时间变化的曲线如右图。
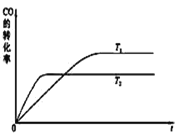
①该反应的焓变ΔH______0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______K2(填“>”、“<”或“=”)。
(4)H2 和CO合成甲醇反应为:CO(g)+2H2(g)![]() CH3OH(g)(正反应是放热反应)。在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。则达到平衡时CO的浓度为_______;10min内用H2表示的化学反应速率为_______;若要加快CH3OH的生成速率并提高CO的转化率,可采取的措施有________________(填一种合理的措施)。
CH3OH(g)(正反应是放热反应)。在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。则达到平衡时CO的浓度为_______;10min内用H2表示的化学反应速率为_______;若要加快CH3OH的生成速率并提高CO的转化率,可采取的措施有________________(填一种合理的措施)。
(5) 二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为: CO2(g) +3H2(g) ![]() CH3OH(g) +H2O(g) △H 。
CH3OH(g) +H2O(g) △H 。
①该反应的平衡常数表达式为K=___________。
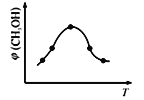
②在恒容密闭容器中使CO2和H2(物质的量之比为1∶3)发生上述反应,反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如下图所示,则△H _________0(填“大于”或“小于”)
【答案】 CH3OH(l) + 3/2O2(g) =CO2(g) + 2H2O(l) △H = -726.51 kJ/mol -192.8kJ/mol < > 0.4mol/L 0.04mol/(L·min) 增大压强(增加H2的量) ![]() 小于
小于
【解析】Ⅰ.(1)101 kPa时,1 mol CH3OH液体完全燃烧生成CO2和液态水时放出热量726.51 kJ,则表示甲醇燃烧的热化学方程式为CH3OH(l) + 3/2O2(g) =CO2(g) + 2H2O(l) △H = -726.51 kJ/mol。
(2)①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1=+49.0 kJ·mol-1 ②CH3OH(g)+ ![]() O2(g)= CO2(g)+2H2(g) △H2 ③H2(g)+
O2(g)= CO2(g)+2H2(g) △H2 ③H2(g)+ ![]() O2(g)===H2O(g) △H = —241.8kJ·mol-1,由①+③可得到②,则反应②的△H2= +49.0 kJ·mol-1 —241.8kJ·mol-1= -192.8 kJ·mol-1 。
O2(g)===H2O(g) △H = —241.8kJ·mol-1,由①+③可得到②,则反应②的△H2= +49.0 kJ·mol-1 —241.8kJ·mol-1= -192.8 kJ·mol-1 。
(3)由图像可知,T2先达平衡,所以T2>T1,温度升高后,CO的平衡转化率降低了,所以正反应为放热反应,其平衡常数随温度升高而减小。
①该反应的焓变ΔH<0。
②T1和T2温度下的平衡常数大小关系是K1>K2。
(4)H2 和CO合成甲醇反应为:CO(g)+2H2(g)![]() CH3OH(g)(正反应是放热反应)。在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。则CO减小了0.4mol,H2减少了0.8mol,达到平衡时CO的浓度为
CH3OH(g)(正反应是放热反应)。在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。则CO减小了0.4mol,H2减少了0.8mol,达到平衡时CO的浓度为![]() mol/L;10min内用H2表示的化学反应速率为
mol/L;10min内用H2表示的化学反应速率为 ![]() 0.04mol/(L·min);若要加快CH3OH的生成速率并提高CO的转化率,因为正反应气体分子数减少,所以加压对正反应有利,另外增大另一种反应物氢气的浓度也可以提高CO的转化率。所以可采取的措施有增大压强(或增加H2的量)。注意不可采取降温措施,因为降温后化学反应速率减小。
0.04mol/(L·min);若要加快CH3OH的生成速率并提高CO的转化率,因为正反应气体分子数减少,所以加压对正反应有利,另外增大另一种反应物氢气的浓度也可以提高CO的转化率。所以可采取的措施有增大压强(或增加H2的量)。注意不可采取降温措施,因为降温后化学反应速率减小。
(5)①该反应的平衡常数表达式为K=![]() 。
。
②由图可知,反应过程中甲醇的体积分数φ(CH3OH)在达到最高后随反应温度升高而减小,则该反应为放热反应,△H小于0 。