题目内容
3.如图所示为实验室中常见的气体制备、净化、收集和性质实验的部分仪器.试根据题目要求,回答下列问题: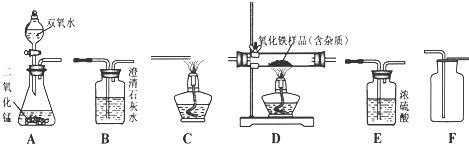
(1)欲在实验室中制备并收集干燥的氧气.
①所选仪器的连接顺序为AEF(填写仪器序号字母).
②仪器A中,发生反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)欲用足量纯净的一氧化碳气体测定某不纯氧化铁样品的纯度(杂质不反应),并验证反应中气体生成物的性质.所选仪器的连接顺序为:纯净的一氧化碳气体→D→B→C.
①仪器C的作用是将多余的CO燃烧掉,防止污染空气或使人中毒.
②仪器D中发生的化学反应方程式为3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$3CO2+2Fe
③反应完全后,计算氧化铁样品的纯度时,小强同学认为“仪器D中减少的质量等于仪器B中增加的质量”.小丽同学通过称量发现二者质量并不相等.请你分析写出仪器D中减少的是氧化铁(或Fe2O3)中的氧(或O)元素的质量,而仪器B中增加的是反应生成的二氧化碳(或CO2)的质量.
分析 (1)①要收集干燥的氧气,可知应选择A作为发生装置,用盛有浓硫酸的洗气瓶干燥,氧气密度大于空气密度,应选择F装置,用向上排空气法收集;
②双氧水在二氧化锰催化条件下,分解生成水与氧气;
(2)①一氧化碳有毒,可以用点燃的方法除去多余的一氧化氮;
②三氧化二铁与一氧化碳在高温条件下发生氧化还原反应生成铁与二氧化碳;
③依据D中反应前后物质分析减少的成分,依据石灰水的性质分析增加的质量.
解答 解:(1)①要收集干燥的氧气,可知应选择A作为发生装置,用盛有浓硫酸的洗气瓶干燥,氧气密度大于空气密度,应选择F装置,正确连接顺序为:AEF;
故答案为:AEF;
②双氧水在二氧化锰催化条件下,分解生成水与氧气,化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(2)①一氧化氮有毒,为防止污染空气或使人中毒,应将多余的CO燃烧掉;
故答案为:将多余的CO燃烧掉,防止污染空气或使人中毒;
②三氧化二铁与一氧化碳反应的方程式:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 3CO2+2Fe;
故答案为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$3CO2+2Fe;
③仪器D中原有物质为氧化铁,反应后为铁,所以减少的成分为氧化铁中的氧元素;
仪器B中的石灰水能够吸收二氧化碳,所以增加的质量为反应生成的二氧化碳;
故答案为:氧化铁(或Fe2O3)中的氧(或O)元素; 反应生成的二氧化碳(或CO2).
点评 本题考查了气体的制备及性质的检验,熟悉气体的性质是解题关键,题目难度不大.

| A. | 运输液氯的铁管被腐蚀 | B. | 金属在潮湿空气中更容易腐蚀 | ||
| C. | 铁与酸反应滴加硫酸铜后反应加快 | D. | 含杂质的锌比纯锌与酸反应快 |
| A. | 3种 | B. | 5种 | C. | 6种 | D. | 7 种 |
| A. | 用铜和稀硫酸反应制取硫酸铜溶液 | |
| B. | 用石灰石除去氯化钙溶液中混有的盐酸 | |
| C. | 用氢氧化钠溶液除去二氧化碳中混有的氯化氢气体 | |
| D. | 用酚酞试液检验暴露在空气中的NaOH固体是否变质 |
| A. | 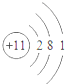 易形成阳离子 | B. | 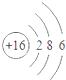 易得电子 | C. |  为稳定结构 | D. |  稀有气体的原子 |
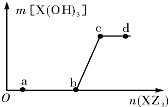 向一定量NaOH溶液中逐滴加AlCl3溶液,生成的沉淀Al(OH)3的质量随AlCl3溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向一定量NaOH溶液中逐滴加AlCl3溶液,生成的沉淀Al(OH)3的质量随AlCl3溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )| A. | d点对应的溶液中:K+、NH4+、CO32-、I- | |
| B. | c点对应的溶液中:Ag+、Ca2+、NO3-、Na+ | |
| C. | b点对应的溶液中:Na+、S2-、SO42-、Cl- | |
| D. | a点对应的溶液中:Na+、K+、SO42-、HCO3- |
| A. | 25℃时,HClO溶液加水稀释,电离程度增大,溶液中H+浓度增大 | |
| B. | 等物质的量浓度的氨水和盐酸等体积混合,存在:2c(NH4+)+c(H+)+c(NH3•H2O)=2c(Cl-)+c(OH-) | |
| C. | MgCl2饱和溶液蒸干可以得到MgCl2•6H2O,继续灼烧得到无水MgCl2 | |
| D. | 已知Ksp(AgCl)=1.8×10-10(mol/L)2,Ksp(Ag2CrO4)=1.8×10-10(mol/L)3,则Ag2CrO4的溶解度小于AgCl |