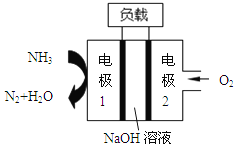
题目内容
【题目】25℃时,向100mL 0.01mol·L-1的NaHA溶液中分别加入浓度均为0.01mol·L-1的NaOH溶液和盐酸,混合溶液的pH随所加溶液体积的变化如图所示(忽略过程中的体积变化)。下列说法不正确的是
A. 25℃时,H2A的第二步电离平衡常数约为10-6
B. 水的电离程度:N>M>P
C. 随着盐酸的不断滴入,最终溶液的pH小于2
D. P点时溶液中存在:2c(H2A)+c(HA-)+c(H+)=c(OH-)+c(Na+)+c(Cl-)
【答案】C
【解析】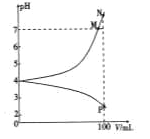
A. 25℃时,H2A的第二步电离平衡常数约为K=c(H+)c(A2-)/c(HA-)=![]() =10-6,故A正确;B. N为Na2A水解促进水电离,M点水解能力较N点弱,P为H2A抑制水电离,水的电离程度:N>M>P,故B正确;C. 随着盐酸的不断滴入,溶液无限接近0.01mol·L-1HCl,最终溶液的pH近似2,但大于2,故C错误;D. P点相当于H2A和NaCl等物质的量混合,P点时溶液中存在:电荷守恒:c(Na+)+c(H+)=c(OH-)+c(Cl-)+2c(A2-)+c(HA-),物料守恒:c(H2A)+c(HA-)+c(A2-)=c(Na+),消去c(A2-),得2c(H2A)+c(HA-)+c(H+)=c(OH-)+c(Na+)+c(Cl-),故D正确;故选C。
=10-6,故A正确;B. N为Na2A水解促进水电离,M点水解能力较N点弱,P为H2A抑制水电离,水的电离程度:N>M>P,故B正确;C. 随着盐酸的不断滴入,溶液无限接近0.01mol·L-1HCl,最终溶液的pH近似2,但大于2,故C错误;D. P点相当于H2A和NaCl等物质的量混合,P点时溶液中存在:电荷守恒:c(Na+)+c(H+)=c(OH-)+c(Cl-)+2c(A2-)+c(HA-),物料守恒:c(H2A)+c(HA-)+c(A2-)=c(Na+),消去c(A2-),得2c(H2A)+c(HA-)+c(H+)=c(OH-)+c(Na+)+c(Cl-),故D正确;故选C。

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目