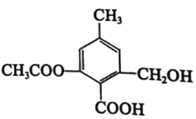
��Ŀ����
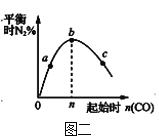
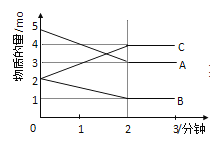
����Ŀ�����淴Ӧ��ij���Ϊ5L���ܱ������н��У��ڴ�0��3���Ӹ����ʵ����ı仯�����ͼ��ʾ(A��B��C��Ϊ����)
��1���÷�Ӧ�Ļ�ѧ����ʽΪ______________��
��2�����º����£�N2(g)+3H2(g) ![]() 2NH3(g)���ﵽƽ��ı�־��_______________��
2NH3(g)���ﵽƽ��ı�־��_______________��
A��3v��(H2)=2v��(NH3)
B���������������������ʱ��仯
C�������ڵ�ѹǿ������ʱ����仯
D�� N2��H2��NH3��Ũ��֮��Ϊ1:2:3
E����λʱ������nmolN2��ͬʱ����3nmolH2
F���Ͽ�һ��N��N����ͬʱ��6��N��H������
������Ϊȼ�ϵ�ȼ�ϵ�أ���������Ч�ʸߵ��ص㣬���ⰱ���������ߣ���Һ����������������棬�Ǻܺõ���Դ���塣ȼ�ϵ�صĽṹ��ͼ��ʾ��
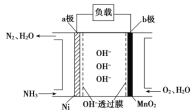
��a���ǵ�ص�______________�������������������������缫��ӦʽΪ________________��
�ڵ�����0.5molN2ʱ����·��ͨ���ĵ��ӵ����ʵ���Ϊ_____��
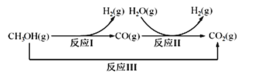
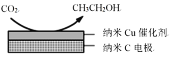
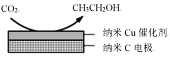
�״�ˮ�����������ⷽ����Ŀǰ�Ƚϳ�������ⷽ�����Ҿ������õ�Ӧ��ǰ�����״�ˮ������������IJ��ַ�Ӧ������ͼ��ʾ��
��1����֪һ��������
��ӦI�� CH3OH(g)=CO(g)+2H2(g) ��H1=+90.7kJ/mol
��ӦIII��CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ��H3=+49.5kJ/mol
�������·�ӦII���Ȼ�ѧ����ʽ��____________________________��
��2����ͼ�����Ե������Һ�У����CO2�����Ʊ��Ҵ���д�������ĵ缫����ʽ��____________________________��
���𰸡�2A(g)+B(g)2C(g) CE �� 2NH3-6e-+6OH-=N2+3H2O 3mol H2O(g)+CO(g)=H2(g)+CO2(g) ��H=-41.2kJ��mol-1 2CO2+12e-+12H+=CH3CH2OH+3H2O
��������
��(1)��ͼ����2�������ʵ����仯ֵ���ݴ�����÷�Ӧ�Ļ�ѧ����ʽ��
(2) ����Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�Ȳ��䣬�ɴ�������һЩ���������䣬�ݴ��ж��������жϺ��º����µ�N2(g)+3H2(g) ![]() 2NH3(g)���ﵽƽ��ı�־���ļ�����
2NH3(g)���ﵽƽ��ı�־���ļ�����
����ȼ�ϵ�صĹ���ԭ����ȼ�ϵ�صĵ缫��ͨ��������ж�����������д�缫����ʽ��������ӵ����ʵ�����
��(1)��ͼ֪�״�ˮ�����������ⷽ����2������һ��Ϊ�ȷ�Ӧ���ٷ�Ӧ�����ڶ���Ϊ��Ӧ��������˹���ɿ����һ�������·�ӦII���Ȼ�ѧ����ʽ��
(2)��ͼ֪���ʱ�����ķ�Ӧ����CO2�õ��ӱ���ԭ���Ҵ����ݴ�д�缫����ʽ��
(1)��ͼ����Կ�����A��B�����ʵ�����С����A��BΪ��Ӧ�C�����ʵ��������࣬����CΪ���������Ӧ����2minʱ����n(A)=2mol����n(B)=1mol����n(C)=2mol����ѧ��Ӧ�У������ʵ����ʵ����ı仯ֵ�뻯ѧ�����������ȣ�����n(A)����n(B)����n(C)=2:1:2�����Է�Ӧ�Ļ�ѧ����ʽΪ��2A(g)+B(g)2C(g)��
�ʴ�Ϊ��2A(g)+B(g)2C(g)��
(2)����Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�Ȳ��䣬�ɴ�������һЩ���������䣬�ݴ��ж��������жϺ��º����µ�N2(g)+3H2(g) ![]() 2NH3(g)���ﵽƽ��ı�־���ļ�����
2NH3(g)���ﵽƽ��ı�־���ļ�����
A�� v��(H2)= v��(H2) Ϊƽ��״̬����2v��(H2)=3v��(NH3) ʱΪƽ��״̬����3v��(H2)=2v��(NH3) ����˵������ƽ��״̬��A����
B���������������ʼ�ղ�����ʱ��仯 ���ʻ����������������ʱ��仯����˵������ƽ��״̬��B����
C�������ڵ�ѹǿ������һ��ʼ��Ӧ���仯����ѹǿ������ʱ����仯����˵������ƽ��״̬��C��ȷ��
D�� N2��H2��NH3��Ũ��֮��ȡ���ڸ����ʵ��������������ߵ�Ũ��֮��Ϊ1:2:3������˵������ƽ��״̬��D����
E����λʱ������nmolN2���ض�������3nmolH2�����ɣ���ͬʱ����3nmolH2������ζ�����������ʵ���Ũ�Ȳ��ٱ仯����˵������ƽ��״̬��E��ȷ��
F���Ͽ�һ��N��N����ͬʱ�ض���6��N��H�����ɣ��ʲ���˵������ƽ��״̬��F����
����CE��
����ʾ��ͼ֪��a��ͨ��ȼ�ϰ�������a���ǵ�صĸ���������ʧȥ���ӱ��������缫��ӦʽΪ2NH3-6e-+6OH-=N2+3H2O��
��������2NH3-6e-+6OH-=N2+3H2O��
���ɵ缫����ʽ2NH3-6e-+6OH-=N2+3H2O֪��������0.5molN2ʱ����·��ͨ���ĵ��ӵ����ʵ���Ϊ3mol��
����3mol��
(1)��ͼ֪�״�ˮ�����������ⷽ����2������һ��Ϊ�ȷ�����Ӧ���ٷ�����Ӧ�����ڶ���Ϊ��Ӧ������֪��ӦI�� CH3OH(g)=CO(g)+2H2(g) ��H1=+90.7kJ/mol
��ӦIII��CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ��H3=+49.5kJ/mol
����˹���ɿ�֪����Ӧ��+��Ӧ��=��Ӧ������ӦII���Ȼ�ѧ����ʽΪH2O(g)+CO(g)=H2(g)+CO2(g) ��H=-41.2kJ��mol-1��
����H2O(g)+CO(g)=H2(g)+CO2(g) ��H=-41.2kJ��mol-1��
(2)��ͼ֪���ʱ�����ķ�Ӧ����CO2�õ��ӱ���ԭ���Ҵ��������Ե������Һ�У���������ʽΪ��2CO2+12e-+12H+=CH3CH2OH+3H2O��
����2CO2+12e-+12H+=CH3CH2OH+3H2O��

 �������ͬ������ϵ�д�
�������ͬ������ϵ�д�����Ŀ��������֪��SiHCl3�ڴ��������¿ɷ������·�Ӧ��
2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ��H1=+48kJ��mol1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3(g) ��H2=30kJ��mol1
(1)д����SiHCl3(g)�ֽ����SiH4(g)��SiCl4(g)���Ȼ�ѧ����ʽΪ__��
����298Kʱ����Һ�д������·�Ӧ��A(aq)![]() B(aq)+H2O(l) ��H>0������A�ij�ʼŨ��Ϊ0.180mol��L-1���������B��Ũ����ʱ��仯�����������ʾ��
B(aq)+H2O(l) ��H>0������A�ij�ʼŨ��Ϊ0.180mol��L-1���������B��Ũ����ʱ��仯�����������ʾ��
t/min | 0 | 21 | 50 | 80 | 100 | 120 | 160 | 220 |
|
c/(mol��L��1) | 0 | 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
�ش��������⣺
(2)�÷�Ӧ��50��80min�ڵ�ƽ����Ӧ����Ϊ__mol��L1��min1��
(3)120minʱA��ת����Ϊ__��
(4)298Kʱ���÷�Ӧ��ƽ�ⳣ��K=__������ʱƽ�ⳣ��__(����������������С��������������)��
(5)Ϊ���A��ƽ��ת���ʣ����ʵ����Ʒ�Ӧ�¶��⣬���ɲ�ȡ�Ĵ�ʩ��__��
(6)����������˵�����淴Ӧ�Ѵ�ƽ�����__��
A.c(A)=c(B)
B.A��B��Ӧ�������
C.A��B�����ʵ�����ֵ���ֺ㶨
D.��Һ�����������ֺ㶨