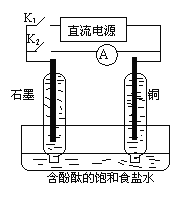
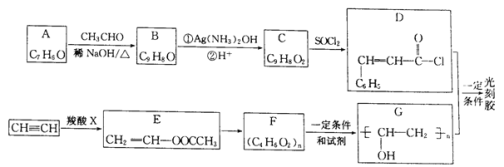
题目内容
【题目】对氨基水杨酸钠(PAS-Na)是抑制结核杆茵最有效的药物。某同学设计的合成PAS-Na的两种路线如下:
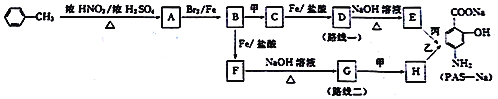
已知以下信息:
①甲、乙、丙为常用的无机试剂;
②![]()
③![]() (苯胺,易被氧化)。
(苯胺,易被氧化)。
回答下列问题:
(1)甲和丙的名称分别是_________________、____________________。
(2)E的结构简式是______________________。
(3)A→B的化学方程式是______________________________________,反应类型是______。
(4)A的同分异构体中氨基(一NH2)与苯环直接相连并且能发生银镜反应的有____种,其中核磁共振氢谱为4组峰且面积之比为2:2:2:1的结构简式为___________。
(5)有同学认为“路线二”不合理,不能制备PAS-Na,你的观点及理由是_____________。
【答案】 高锰酸钾酸性溶液 二氧化碳 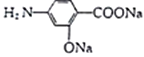
![]() 取代反应 13
取代反应 13 ![]() 路线二不能制备PAS-Na,当苯环上连接有一NH2时,-NH2会被KMnO4酸性溶液氧化
路线二不能制备PAS-Na,当苯环上连接有一NH2时,-NH2会被KMnO4酸性溶液氧化
【解析】由对氨基水杨酸钠的结构可知,![]() 与浓硝酸,在浓硫酸、加热条件下发生对位硝化反应生成A,则A为
与浓硝酸,在浓硫酸、加热条件下发生对位硝化反应生成A,则A为![]() ,A与溴在Fe作催化剂条件下发生取代反应生成B,由对氨基水杨酸钠的结构可知,应发生甲基的邻位取代,故B为
,A与溴在Fe作催化剂条件下发生取代反应生成B,由对氨基水杨酸钠的结构可知,应发生甲基的邻位取代,故B为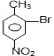 ;路线一的设计目的是,由于酚羟基、氨基易被氧化,故生成C的反应应为氧化反应,B被酸性高锰酸钾氧化生成C,则C为
;路线一的设计目的是,由于酚羟基、氨基易被氧化,故生成C的反应应为氧化反应,B被酸性高锰酸钾氧化生成C,则C为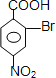 ,C在Fe、盐酸条件下发生还原反应生成D为
,C在Fe、盐酸条件下发生还原反应生成D为 ,D在碱性条件下水解生成E为
,D在碱性条件下水解生成E为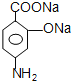 ,E转化对氨基水杨酸钠,只有E中酚羟基反应,而相同条件下,同浓度的对氨基水杨酸的酸性强于醋酸,故丙可以为二氧化碳;路线二的设计目的是,B在Fe、盐酸条件下发生还原反应生成F为
,E转化对氨基水杨酸钠,只有E中酚羟基反应,而相同条件下,同浓度的对氨基水杨酸的酸性强于醋酸,故丙可以为二氧化碳;路线二的设计目的是,B在Fe、盐酸条件下发生还原反应生成F为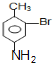 ,F发生水解反应生成G为
,F发生水解反应生成G为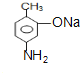 ,再用酸性高锰酸钾氧化,G中甲基、氨基都会被氧化,合成失败。
,再用酸性高锰酸钾氧化,G中甲基、氨基都会被氧化,合成失败。
(1)由上述分析可知,甲的名称是酸性高锰酸钾溶液,丙的化学式是CO2;
(2) 在碱性条件下水解生成E,则E的结构简式是
在碱性条件下水解生成E,则E的结构简式是 ;
;
(3)A→B的反应为![]() 与溴在Fe作催化剂条件下发生取代反应生成
与溴在Fe作催化剂条件下发生取代反应生成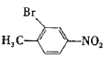 ,反应的化学方程式是:
,反应的化学方程式是: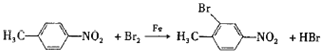 ;
;
(4)A的同分异构体中氨基(一NH2)与苯环直接相连并且能发生银镜反应,说明A的同分异构体中含有醛基或甲酸酯基结构,若含有醛基,则一定还含有羟基,应该有10种结构;若含有甲酸酯基结构,应该有3种结构,共有13种。核磁共振氢谱为4组峰且面积之比为2:2:2:1的结构简式为![]() 。
。
(5)路线二:B在Fe、盐酸条件下发生还原反应生成F为 ,F发生水解反应生成G为
,F发生水解反应生成G为 ,再用酸性高锰酸钾氧化,G中甲基、氨基都会被氧化,合成失败。
,再用酸性高锰酸钾氧化,G中甲基、氨基都会被氧化,合成失败。