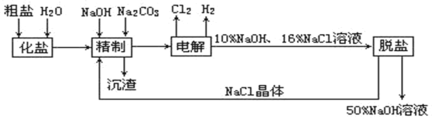
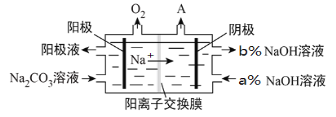
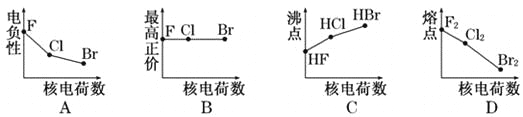
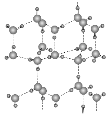
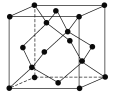
题目内容
【题目】下列常见分子中心原子的杂化轨道类型是SP3的是:( )
A. PH3B. BF3C. SO2D. CO2
【答案】A
【解析】
根据价层电子对互斥理论确定原子杂化方式,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=![]() ,a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数,据此判断杂质类型,中心原子的杂化类型为sp3,说明该分子中心原子的价层电子对个数是4。
,a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数,据此判断杂质类型,中心原子的杂化类型为sp3,说明该分子中心原子的价层电子对个数是4。
A.BF3中B原子杂化轨道数为=3+![]() =3,中心原子杂化类型为sp2杂化,A项不符合要求;
=3,中心原子杂化类型为sp2杂化,A项不符合要求;
B.PH3中P原子杂化轨道数为=3+![]() =4中心原子杂化类型为sp3杂化,B项符合题意;
=4中心原子杂化类型为sp3杂化,B项符合题意;
C.SO2中S原子杂化轨道数为=3+![]() =3,中心原子杂化类型为sp2杂化,C项不符合题意;
=3,中心原子杂化类型为sp2杂化,C项不符合题意;
D.CO2中C原子杂化轨道数为=2+![]() =2,中心原子杂化类型为 sp杂化,D项不符合题意;
=2,中心原子杂化类型为 sp杂化,D项不符合题意;
本题答案选B。

【题目】下表是元素周期表的一部分,针对表中的![]() 元素,用元素符号或化学式填空回答以下问题:
元素,用元素符号或化学式填空回答以下问题:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
二 |
|
| ||||||
三 |
|
|
|
|
|
| ||
四 |
|
|
(1)化学性质最不活泼的元素原子的原子结构示意图为________;
(2)元素![]() 、
、![]() 的简单氢化物中的稳定性最强的是______________
的简单氢化物中的稳定性最强的是______________![]() 用化学式表示
用化学式表示![]() ;
;
(3)元素的最高价氧化物对应的水化物中酸性最强的是________,碱性最强的是_______,呈两性的氢氧化物是_______________,元素![]() 的最高价氧化物对应水化物中含有的化学键类型为________________;
的最高价氧化物对应水化物中含有的化学键类型为________________;
(4)在![]() 四种元素中,简单离子半径最小的是_________;
四种元素中,简单离子半径最小的是_________;
(5)![]() 的电子式为___________;
的电子式为___________;![]() 的电子式为_________;
的电子式为_________;
(6)在![]() 与
与![]() 的单质中,氧化性较强的是__________,用化学反应方程式证明:___________________________。
的单质中,氧化性较强的是__________,用化学反应方程式证明:___________________________。