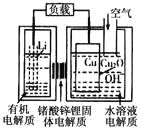
题目内容
【题目】乙二醇(![]() )是一种重要的化工原料,
)是一种重要的化工原料,
Ⅰ.在一定条件下以CO和H2为原料可以合成乙二醇,反应方程式如下:
2CO(g)+3H2(g) ![]()
![]() (g) ΔH= a kJ/mol
(g) ΔH= a kJ/mol
(1)该反应能够自发进行,可以推出a 0;(填“>”“<”或“=”)。
(2)在一定温度下,向体积为1L的恒容密闭容器中充入2 mol CO (g)和3mol H2(g),压强为P1,达到平衡时压强变为P2,且P1:P2=15:7,则该温度下的化学平衡常数K=______
(3)只改变反应的一个条件,能使平衡体系中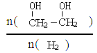 增大的措施有 (写两条)
增大的措施有 (写两条)
Ⅱ.乙二醇经连续催化氧化后可得到乙二酸(HOOC-COOH),乙二酸俗称草酸,分子式可以用H2C2O4表示,H2C2O4是一种二元弱酸,常温下其电离平衡常数K1=5.0×10-2,K2=5.0×10-5
(1)H2C2O4的电离方程式为 。
(2)Na2C2O4溶液显 (填“酸性”、“中性”或“碱性”),溶液中各离子浓度从大到小的顺序为 。
(3)已知常温下NH3·H2O的电离平衡常数K=1.75×10-5,常温下,
反应NH3·H2O + HC2O4- ![]() NH4+ +C2O42-+H2O的平衡常数K= 。
NH4+ +C2O42-+H2O的平衡常数K= 。
【答案】 Ⅰ.(1) a<0 (2)1.5(3)降温、加压、增加CO的浓度或及时将乙二醇从混合物中分离出来
Ⅱ.(1)H2C2O4![]() H++HC2O4- ; HC2O4-
H++HC2O4- ; HC2O4- ![]() H++C2O42-
H++C2O42-
(2)碱性 c(Na+) >c(C2O42-)>c(OH-)>c(HC2O4-) >c(H+)(3)8.75×104
【解析】
试题分析:Ⅰ.(1)根据反应能自发的条件可知,熵增会使反应自发,放热也会使反应自发,该反应为熵减的反应,所以要使反应自发,则△H<0,所以a<0,故答案为:<;
(2)利用三段式分析,
根据反应2CO(g)+3H2(g)![]() (g)
(g)
起始(mol/L) 2 3 0
转化(mol/L) 2x 3x x
平衡(mol/L)2﹣2x 3﹣3x x
有![]() =15:7,x=
=15:7,x=![]() ,所以平衡时CO、H2、
,所以平衡时CO、H2、![]() 的浓度依次是
的浓度依次是![]() mol/L、1mol/L、
mol/L、1mol/L、![]() mol/L,则该温度下的化学平衡常数K=
mol/L,则该温度下的化学平衡常数K=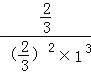 =1.5,故答案为:1.5;
=1.5,故答案为:1.5;
(3)能使平衡体系中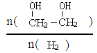 增大,即平衡向正反应方程移动,该反应为气体体积减小的放热反应,所以可采取的措施有降温、加压、增加CO的浓度或及时将乙二醇从混合物中分离出来,故答案为:降温、加压、增加CO的浓度或及时将乙二醇从混合物中分离出来;
增大,即平衡向正反应方程移动,该反应为气体体积减小的放热反应,所以可采取的措施有降温、加压、增加CO的浓度或及时将乙二醇从混合物中分离出来,故答案为:降温、加压、增加CO的浓度或及时将乙二醇从混合物中分离出来;
Ⅱ.(1)酸是二元弱酸分步电离,电离方程式为:H2C2O4H++HC2O4﹣,HC2O4﹣H++C2O42﹣;
(2)Na2C2O4为强碱弱酸盐,草酸根水解,溶液呈碱性,一级水解程度大于二级水解程度,所以溶液中离子浓度大小关系 为c(Na+)>c(C2O42﹣)>c(OH﹣)>c(HC2O4﹣)>c(H+),
故答案为:碱性;c(Na+)>c(C2O42﹣)>c(OH﹣)>c(HC2O4﹣)>c(H+);
(3)根据反应NH3H2O+HC2O4﹣═NH4++C2O42﹣+H2O可知,平衡常数K=![]() ═
═![]()
![]() =
=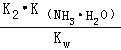 =
=![]() =8.75×104,
=8.75×104,
故答案为:8.75×104

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】短周期元素 W、X、Y、Z 在元素周期表中的位置如右图所示。其中 Z 的单质是一种重要半导体材料,广泛应用于电子工业的各个领域。
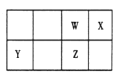
(1)W 在元素周期表中的位置是____________。
(2)W、X、氢元素形成的三原子分子的电子式____________。
(3)下列选项中,能证明元素非金属性X强于W的是____________。
A.相对原子质量:X>W | B.最低化合价:X>W |
C.最简单氢化物的稳定性:X>W | D.最高价氧化物的水化物酸性:X>W |
(4)元素周期表中与 Z 同周期的某金属元素形成的单质 A,可发生如下图所示的转化:
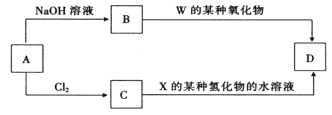
其中化合物D是一种白色沉淀,则 B 中溶质的化学式为____________;
B与 C也可直接转化生成 D 写出对应的离子方程式为____________。