题目内容
7.两种气态烃混合气体共1L,在空气中完全燃烧得到1.5L CO2和2.5L水蒸气(气体体积均在150℃条件下测定),关于此混合气体的判断合理的是( )| A. | 一定含有甲烷 | B. | 一定有乙烷 | ||
| C. | 可能是乙烷和甲烷的混合气体 | D. | 可能是甲烷和丙烯(C3H6)的混合气体 |
分析 两种气态烃的混合物共1L,在空气中完全燃烧得到1.5L CO2、2.5L水蒸气,根据相同体积下气体的体积之比等于物质的量之比,据此可计算出混合烃的平均分子式为C1.5H5,利用平均值法对各选项进行判断.
解答 解:两种气态烃的混合物共1L,在空气中完全燃烧得到1.5L CO2、2.5L水蒸气,
根据n=$\frac{V}{{V}_{m}}$可知,相同条件下气体的物质的量与体积成正比,则混合烃的平均分子式为C1.5H5,
A.气态烃中不含碳原子为1.5的烃,所以混合气体分子组成肯定含有小于1.5和大于1.5的烃,小于1.5的烃只能为甲烷,故A正确;
B、C.由于甲烷含有4个H原子,混合烃中含有5个H原子,所以另一种肯定含有的H数目大于5,可能为乙烷等物质,故B错误、C正确;
D.如为甲烷和丙烯的混合物,则满足H原子数为5时二者物质的量之比应为1:1,但此时平均C原子数为2,故D错误.
故选AC.
点评 本题考查了有机物分子组成的推断,题目难度中等,反应物和生成物之间体积关系确定气态烃的平均化学式,再利用平均化学式来分析解答,试题有利于培养学生的分析、理解能力.

练习册系列答案
相关题目
15.对下列粒子的说法错误的是( )
①CH4、②CH2=CH2、③HC≡CH、④NH3、⑤NH4+、⑥BF3、⑦H2O.
①CH4、②CH2=CH2、③HC≡CH、④NH3、⑤NH4+、⑥BF3、⑦H2O.
| A. | 粒子的立体构形呈四面体形的是①⑤ | |
| B. | 中心原子采取sp3杂化的是①④⑤⑦ | |
| C. | 所有原子共线或共面的只有②③⑥ | |
| D. | 粒子中含有配位键的是⑤,含有极性键的极性分子是④⑦ |
2.下列关于有机物的说法正确的是( )
| A. | 只用一种试剂就可以鉴别乙醇、乙酸、四氯化碳、苯四种液体 | |
| B. | 乙醇、乙醛、乙酸都易溶于水,都能与金属钠反应放出氢气? | |
| C. | 糖类、油脂、蛋白质是重要的营养物质,都能发生水解反应? | |
| D. | 甲烷、乙烯和苯都可以从石油中提取,都能使溴水褪色? |
12.下列各对物质中,互为同系物的是( )
| A. | CH3-CH2-CH3和 CH3-CH=CH2 | B. | CH3-CH=CH2和 CH3-CH2-CH=CH2 | ||
| C. | CH3-CH3和 CH3-CH=CH2 | D. | CH2=CH2和 CH≡CH |
19.下列有关化学反应速率和限度的说法中,不正确的是( )
| A. | 实验室用H2O2分解制O2,加入MnO2后,反应速率明显加快 | |
| B. | 在金属钠与足量水反应中,增加水的量能加快反应速率 | |
| C. | 2SO2+O2═2SO3,反应中,SO2不能全部转化为SO3 | |
| D. | 实验室用碳酸钙和盐酸反应抽取CO2,用碳酸钙粉末比块状碳酸钙反应要快 |
16.下列反应的离子方程式正确的是( )
| A. | 苯酚钠溶液中通入少量二氧化碳:2 +2H2O+CO2→2 +2H2O+CO2→2 +CO32- +CO32- | |
| B. | 等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 向AlCl3溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 同位素示踪法可用于反应机理的研究:2KMnO4+5H218O2+3H2SO4═K2SO4+2MnSO4+518O2↑+8H2O |
7.海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图所示).下列有关说法正确的是( )


| A. | 第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液-→NaOH溶液-→BaCl2溶液-→过滤后加盐酸 | |
| B. | 工业上金属钠是通过氯碱工业制取 | |
| C. | 从第③步到第⑤步的目的是为了富集溴元素 | |
| D. | 在第③④⑤步中溴元素均被氧化 |
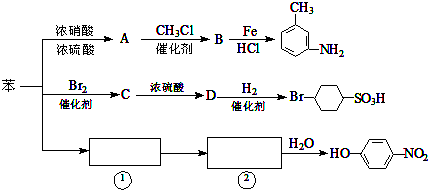
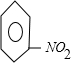 +CH3Cl$\stackrel{催化剂}{→}$
+CH3Cl$\stackrel{催化剂}{→}$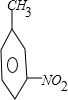 +HCl.
+HCl.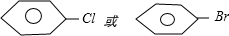 ,②
,② 或
或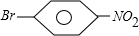 .
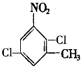
.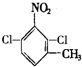 、
、
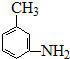 的所有原子不是(填“是”或“不是”)在同一平面上.
的所有原子不是(填“是”或“不是”)在同一平面上.