题目内容
15.对下列粒子的说法错误的是( )①CH4、②CH2=CH2、③HC≡CH、④NH3、⑤NH4+、⑥BF3、⑦H2O.
| A. | 粒子的立体构形呈四面体形的是①⑤ | |
| B. | 中心原子采取sp3杂化的是①④⑤⑦ | |
| C. | 所有原子共线或共面的只有②③⑥ | |
| D. | 粒子中含有配位键的是⑤,含有极性键的极性分子是④⑦ |
分析 A.根据杂化轨道数判断杂化类型判断微粒的构型来解答,①CH4是正四面体结构,②C2H4是平面形分子 ③C2H2是直线形分子 ④NH3是三角锥形分子,⑤NH4+是正四面体结构,⑥BF3是平面三角形分子 ⑦H2O是V形分子;
B.根据杂化轨道数判断杂化类型,杂化轨道数=δ键数+孤对电子对数,据此判断杂质类型;
C.根据①CH4是正四面体结构,②C2H4是平面形分子 ③C2H2是直线形分子 ④NH3是三角锥形分子,⑤NH4+是正四面体结构,⑥BF3是平面三角形分子 ⑦H2O是V形分子分析;
D.在物质或离子中中心原子含有空轨道,和含有孤电子对的原子或离子能形成配位键,由同种原子构成的共价键是非极性键,不同原子构成的共价键是极性键,以极性键结合的双原子一定为极性分子,以极性键结合的多原子分子如结构不对称,正负电荷的重心不重合,电荷分布不均匀,则为极性分子,反之为非极性分子.
解答 解:A.①CH4中C原子采取sp3杂化,空间构型为正四面体结构,②C2H4中C原子采取sp2杂化,空间构型为平面形分子,③C2H2中C原子采取sp杂化,空间构型为直线形分子 ④NH3中氮原子采取sp3杂化,空间构型为三角锥形分子,⑤NH4+中氮原子采取sp3杂化,空间构型为正四面体结构,⑥BF3中硼原子采取sp2杂化,空间构型为平面三角形分子 ⑦H2O中O原子采取sp3杂化,空间构型为V形分子,所以粒子的立体构形呈四面体形的是①④⑤,故A错误;
B.①CH4中C原子杂化轨道数=δ键数+孤对电子对数=4+0=4,所以采取sp3杂化,②C2H4中C原子杂化轨道数=δ键数+孤对电子对数=3+0=3,所以采取sp2杂化,③C2H2中C原子杂化轨道数=δ键数+孤对电子对数=2+0=2,所以采取sp杂化,④NH3中氮原子杂化轨道数=δ键数+孤对电子对数=3+1=4,所以采取sp3杂化;⑤NH4+中氮原子杂化轨道数=δ键数+孤对电子对数=4+0=4,所以采取sp3杂化;⑥BF3中B原子杂化轨道数=δ键数+孤对电子对数=3+0=3,所以采取sp2杂化,⑦H2O中O原子杂化轨道数=δ键数+孤对电子对数=2+2=4,所以采取sp3杂化;所以中心原子采取sp3杂化的是①④⑤⑦,故B正确;
C.①CH4是正四面体结构,所有原子不共面也不共线,②C2H4是平面形分子,所有原子共平面而不共线;③CH≡CH是直线形分子,所有原子共平面也共线;④NH3是三角锥形分子,所有原子不共面也不共线,⑤NH4+是正四面体结构,所有原子不共面也不共线,⑥BF3是平面三角形分子,所有原子共平面而不共线;⑦H2O是V形分子,所有原子共平面而不共线,所以所有原子共线或共面的只有②③⑥,故C正确;
D.①甲烷中碳原子满足8电子稳定结构,氢原子满足2电子稳定结构,无空轨道,无孤电子对,CH4不含有配位键;CH4中含有C-H极性键,是正四面体结构,正负电荷的重心重合,电荷分布均匀,则为非极性分子;②CH2=CH2碳原子满足8电子稳定结构,氢原子满足2电子稳定结构,无空轨道,无孤电子对,C2H4不含有配位键,C2H4含有碳氢极性键是平面形分子,正负电荷的重心重合,电荷分布均匀,则为非极性分子;③HC≡CH碳原子满足8电子稳定结构,氢原子满足2电子稳定结构,无空轨道,无孤电子对,C2H2不含有配位键,CH≡CH含有碳氢极性键是直线形分子,正负电荷的重心重合,电荷分布均匀,则为非极性分子;④NH3分子中氮原子含有孤电子对,但无空轨道,无配位键,NH3含有N-H极性键,是三角锥形分子,结构不对称,正负电荷的重心不重合,电荷分布不均匀,则为极性分子;⑤NH4+中氨气分子氮原子含有孤电子对,氢离子提供空轨道,可以形成配位键,NH4+含有配位键,NH4+含有N-H极性键,是正四面体结构的离子;⑥BF3氟原子含有孤电子对,无空轨道,不含有配位键,BF3含有硼氟极性键是平面三角形分子,正负电荷的重心重合,电荷分布均匀,则为非极性分子;⑦H2O中O提供孤电子对,无空轨道,H2O不含有配位键,含有H-O极性键是V形分子,结构不对称,正负电荷的重心不重合,电荷分布不均匀,则为极性分子;所以粒子中含有配位键的是⑤,含有极性键的极性分子是④⑦,故D正确;
故选A.
点评 本题主要考查了原子的杂化、分子的空间构型、原子共面、配位键的判断、分子的极性等知识,为高频考点,根据杂化轨道数判断杂化类型,注意配位键形成的条件,一方要提供空轨道,另一方提供孤电子对,题目难度中等.

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案| A. | N2 | B. | SO2 | C. | CO2 | D. | C12 |
| A. | 乙醇、乙烷和乙酸都可以与钠反应生成氢气 | |
| B. | 聚乙烯不能使酸性高锰酸钾褪色 | |
| C. | 乙烷和丙烯的物质的量共1 mol,完全燃烧生成3 mol H2O | |
| D. | 丙烯与水加成反应的产物存在同分异构体 |
| A. | 淀粉和纤维素 | B. | 甲烷和乙烷 | C. | 12C和14C | D. | 蔗糖和麦芽糖 |
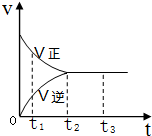
| A. | t1时,只有正方向反应 | B. | t2时,反应到达限度 | ||
| C. | t2-t3,反应表面静止 | D. | t2-t3,各物质的浓度不再发生变化 |
| A. | 一定含有甲烷 | B. | 一定有乙烷 | ||
| C. | 可能是乙烷和甲烷的混合气体 | D. | 可能是甲烷和丙烯(C3H6)的混合气体 |
| A. | “温室效应”、“光化学烟雾”、“硝酸型酸雨”的形成主要都跟氮氧化合物有关 | |
| B. | 新的环境空气质量标准(AQI)增加了pM2.5(可吸入大颗粒物)的指标 | |
| C. | 在银的催化作用下用乙烯制环氧乙烷: 能体现绿色化学中最理想的“原子经济” | |
| D. | 从海水中获得蒸馏水的操作中,通过温度计控制溶液的温度 |
如图所示的电解池I和II中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d.符合上述实验结果的盐溶液是( )
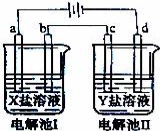
选项 | X | Y |
A | MgSO4 | CuSO4 |
B | AgNO3 | Pb(NO3)2 |
C | FeSO4 | Al2(SO4)3 |
D | CuSO4 | AgNO3 |
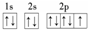 ;E3+的离子符号为Fe3+.
;E3+的离子符号为Fe3+.