题目内容
7.海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图所示).下列有关说法正确的是( )
| A. | 第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液-→NaOH溶液-→BaCl2溶液-→过滤后加盐酸 | |
| B. | 工业上金属钠是通过氯碱工业制取 | |
| C. | 从第③步到第⑤步的目的是为了富集溴元素 | |
| D. | 在第③④⑤步中溴元素均被氧化 |
分析 A、除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可以加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除钙离子和过量的钡离子,盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,加氢氧化钠和氯化钡无先后顺序要求;
B、氯碱工业是指电解饱和食盐水,工业制备钠是电解熔融氯化钠;
C、第③步将溴离子被氧化为溴单质,第④步中溴单质被还原为溴离子,第⑤步中溴离子被氧化为溴单质是浓缩富集;
D、根据物质的性质以及变化结合元素化合价的变化判断;
解答 解:A、镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以正确的顺序为NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸,故A错误;
B、氯碱工业是指电解饱和食盐水,钠是活泼金属不能在溶液中得到,工业制备钠是电解熔融氯化钠,故B错误;
C、第③步将溴离子被氧化为溴单质,第④步中溴单质被还原为溴离子,第⑤步中溴离子被氧化为溴单质,过程的目的是浓缩富集溴元素,故C正确.
D、海水提溴是先通入足量氯气氧化溴离子为溴单质,然后将溴单质还原为溴化氢,再通入适量氯气氧化溴离子为溴单质,④中溴得电子化合价降低,所以溴元素被还原,故D错误;
故选C.
点评 本题考查了海水资源及其综合利用,难点是除杂过程中加入药品的先后顺序,要根据物质的特点来分析解答,难度中等.

| A. | 一定含有甲烷 | B. | 一定有乙烷 | ||
| C. | 可能是乙烷和甲烷的混合气体 | D. | 可能是甲烷和丙烯(C3H6)的混合气体 |
如图所示的电解池I和II中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d.符合上述实验结果的盐溶液是( )
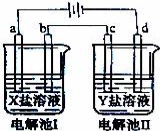
选项 | X | Y |
A | MgSO4 | CuSO4 |
B | AgNO3 | Pb(NO3)2 |
C | FeSO4 | Al2(SO4)3 |
D | CuSO4 | AgNO3 |
| A. | 通常蔗糖和淀粉都不显还原性 | |
| B. | 纤维素分子是由葡萄糖单元组成的,可以表现出一些多元醇的性质 | |
| C. | 油脂是热能最高的营养物质 | |
| D. | 铜盐可以使蛋白质产生盐析 |
| A. | 甲烷、乙烯、乙炔 | B. | 苯、汽油、乙酸乙酯 | ||
| C. | 甲醇、乙醇、苯 | D. | 己烯、苯、四氯化碳 |
| A. | A2B | B. | AB2 | C. | AB3 | D. | A2B5 |

| A. | 铜是负极,铜片上有气泡产生 | |
| B. | 铜片是正极,该电极周围溶液pH不变 | |
| C. | 电子流从锌片经导线流向铜片 | |
| D. | 氢离子在锌片表面被还原 |