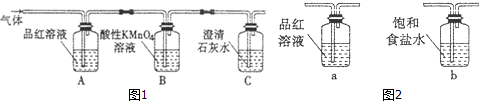
题目内容
13.下列说法正确的一组是( )①不溶于水的盐(CaCO3、BaSO4等)都是弱电解质
②可溶于水的盐都是强电解质
③0.5mol•L-1所有一元酸溶液中氢离子浓度都是0.5mol•L-1
④强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
⑤电解质溶液导电的原因是溶液中有自由移动的阴、阳离子
⑥熔融的电解质都能导电.
| A. | ①③⑤⑥ | B. | ②④⑤⑥ | C. | 只有⑤ | D. | 只有⑥ |
分析 ①电解质的强弱与溶解性无关;
②大多数盐均为强电解质,与溶解度无关;
③一元酸溶液中H+浓度与酸的浓度、酸的强弱有关;
④H+浓度与酸的浓度、分子中氢离子的个数以及电离程度有关,与电解质的强弱无关;
⑤溶液导电的原因是溶液中有自由移动的阴阳离子;
⑥酸在熔融态时不导电.
解答 解:①电解质的强弱与溶解性无关,不溶于水的盐可能是强电解质,CaCO3、BaSO4均是强电解质,故①错误;
②绝大多数的盐属于强电解质,少部分盐属于弱电解质,如醋酸铅就属于弱电解质,与溶解度无关,故②错误;
③0.5mol/L一元酸溶液H+浓度不一定为0.5mol/L,如醋酸小于0.5mol/L,硫酸为1mol/L,故③错误;
④强酸溶液中的H+浓度不一定大于弱酸溶液中的H+浓度,H+浓度与酸的浓度、分子中氢离子的个数以及电离程度有关,与电解质的强弱无关,故④错误;
⑤电解质溶液导电的原因是溶液中有自由移动的阴阳离子,故⑤正确;
⑥酸为共价化合物,在熔融态时均不导电,只有溶于水时才导电,故⑥错误;
故选C.
点评 本题主要考查的是强弱电解质的概念以及判断,涉及溶液导电的原因、溶液中离子浓度大小比较等,难度不大.

练习册系列答案
相关题目
3.荧光素是发光物质的基质,5-羧基荧光素与5-羧基荧光素二乙酸酯在碱性条件下有强烈的绿色荧光,它们广泛应用于荧光分析等.下列说法正确的是( )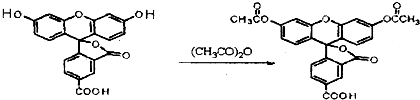
5-羧基荧光素(5-FAM) 5-羧基荧光素二乙酸酯(5-CFDA)
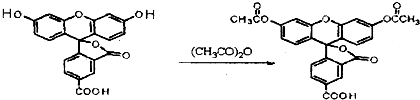
5-羧基荧光素(5-FAM) 5-羧基荧光素二乙酸酯(5-CFDA)
| A. | 5-FAM转变为5-CFDA属于取代反应 | |
| B. | 实验室鉴别5-FAM与5-CFDA可用碳酸氢钠溶液 | |
| C. | 5-FAM的分子式为:C21H3O7 | |
| D. | 5-FAM和5-CFDA分子中的所有原子均共面 |
4. 全电动汽车使用的是钴酸锂电池,其工作原理如图,A极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.则有关说法不正确的是( )
全电动汽车使用的是钴酸锂电池,其工作原理如图,A极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.则有关说法不正确的是( )
 全电动汽车使用的是钴酸锂电池,其工作原理如图,A极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.则有关说法不正确的是( )
全电动汽车使用的是钴酸锂电池,其工作原理如图,A极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.则有关说法不正确的是( )| A. | 放电时电子从A极通过导线流向B极有关 | |
| B. | 放电时A是负极,电极反应式为:LixC6-xe-=C6+xLi+ | |
| C. | 充电时Li+从左边流向右边 | |
| D. | 充电时B作阳极,电极反应式为:LiCoO2-xe-=Li1-xCoO2+xLi+ |
1.下列说法不正确的是( )
| A. | 在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO3)2固体,铜粉仍不溶解 | |
| B. | 某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性 | |
| C. | 铜与稀硝酸反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | |
| D. | HNO3→NO→NO2,以上各步变化均能通过一步实现 |
8.下列有关实验操作说法中,正确的是( )
①用pH试纸测得氯水的pH为2
②仅用量筒、试管、玻璃棒、蒸馏水和pH试纸,可以鉴别pH相等的H2SO4和CH3COOH溶液
③分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
④用碱式滴定管量取25.00mL溴水
⑤可用渗析的方法除去淀粉中混有的少量NaCl杂质
⑥在进行过滤操作时,为了加快过滤速率,可用玻璃棒不断搅拌过滤器中液体.
①用pH试纸测得氯水的pH为2
②仅用量筒、试管、玻璃棒、蒸馏水和pH试纸,可以鉴别pH相等的H2SO4和CH3COOH溶液
③分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
④用碱式滴定管量取25.00mL溴水
⑤可用渗析的方法除去淀粉中混有的少量NaCl杂质
⑥在进行过滤操作时,为了加快过滤速率,可用玻璃棒不断搅拌过滤器中液体.
| A. | ①③⑤ | B. | ②③⑤ | C. | ③④⑤ | D. | ①③④⑥ |
18.下列叙述正确的是( )
| A. | 稀硝酸、稀硫酸均能将木炭氧化成二氧化碳 | |
| B. | Na2O2与水反应,红热的Fe与水蒸气反应均能生成气体 | |
| C. | Li、C、P分别在足量氧气中燃烧均生成一种相应氧化物 | |
| D. | NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体 |
2.乙烯保鲜膜按材质可分为聚乙烯(PE)、聚氯乙烯(PVC)等.工业上以乙烯和氯气为主要原料来合成PE和PVC的流程如下所示.下列说法正确的是( )
PE$\stackrel{①}{←}$乙烯$\stackrel{②}{→}$A$\stackrel{③}{→}$B $\stackrel{④}{→}$PVC.
PE$\stackrel{①}{←}$乙烯$\stackrel{②}{→}$A$\stackrel{③}{→}$B $\stackrel{④}{→}$PVC.
| A. | PE和PVC制成的保鲜膜均有毒,不能用于保鲜食品 | |
| B. | 乙烯、聚乙烯和聚氯乙烯均能与溴水发生加成反应,使之褪色 | |
| C. | 上述流程中A是ClCH2CH2Cl,B是CH2═CHCl | |
| D. | ①②③④四步反应中,无消去反应 |
3.把金属钠和金属钠在空气中的燃烧产物P分别加入到足量的水中,生成的气体在一定条件下恰好完全反应,则与水反应的金属钠与被氧化成P的金属钠的质量比为( )
| A. | 23:78 | B. | 2:1 | C. | 1:1 | D. | 46:78 |