题目内容
【题目】某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。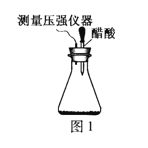
(1)请完成以下实验设计表(表中不要留空格):
编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
② | 醋酸浓度的影响 | 0.5 | ______ | 36.0 |
③ | _________ | 0.2 | 2.0 | 90.0 |
(2)编号①实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了______腐蚀,负极的电极反应式为______。请在图3中用箭头标出发生该腐蚀时电子流动方向______;此时,碳粉表面发生了______(“氧化”或“还原”)反应。
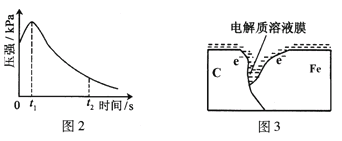
(3)该小组对图2中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:___________________。
【答案】 2.0 碳粉质量的影响 吸氧 Fe-2e-=Fe2+ 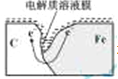 还原 反应放热,温度升高使气压变大
还原 反应放热,温度升高使气压变大
【解析】(1)探究影响化学反应速率,采用控制变量法,每次只能改变一个变量,故有②中铁的量不变,为2.0g;③中改变了碳粉的质量,故为探究碳粉的量对速率的影响。
(2)压强与气体的物质的量成正比,从图中可以看出,气体的量开始增加,后减少,故为吸氧腐蚀,活泼金属做负极,负极的电极反应式为:Fe-2e-=Fe2+,腐蚀时电子流动方向是负极流正极,如图所示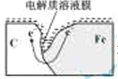 ;碳为正极,故碳粉表面发生还原反应。
;碳为正极,故碳粉表面发生还原反应。
(3)基于图中0~t1时压强变大,可能是产生气体或单位时间速率加快,或是气体受热膨胀等原因分析,假设一是产生氢气,假设二则可能是反应放热,温度升高,体积增大。

练习册系列答案
相关题目





