题目内容
【题目】在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的( )
A.2Na2O2+2H2O=4NaOH+O2↑
B.Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
C.Cl2+H2O=HClO+HCl
D.NH4Cl+NaOH ![]() NaCl+NH3↑+H2O
NaCl+NH3↑+H2O
【答案】A
【解析】解:A.该反应中2Na2O2+2H2O=4NaOH+O2↑中有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成,故A正确;
B.该反应Mg3N2+6H20=3Mg(OH)2↓+2NH3↑没有非极性键的断裂和形成,故B错误;
C.该反应Cl2+H2O=HClO+HCl中,没有离子键的断裂和形成,没有非极性共价键的形成,故C错误;
D.该反应NH4Cl+NaOH=NaCl+H20+NH3↑中没有非极性键的断裂和形成,故D错误;
故选A.
【考点精析】关于本题考查的极性键和非极性键,需要了解非极性键:由同种元素的原子间的原子间形成的共价键(共用电子对不偏移);极性键:由不同元素的原子间形成的共价键(共用电子对偏向吸引电子能力强的一方)才能得出正确答案.

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
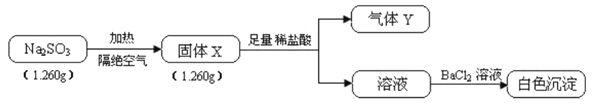
金状元绩优好卷系列答案【题目】某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。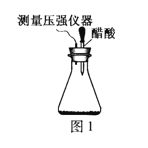
(1)请完成以下实验设计表(表中不要留空格):
编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
② | 醋酸浓度的影响 | 0.5 | ______ | 36.0 |
③ | _________ | 0.2 | 2.0 | 90.0 |
(2)编号①实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了______腐蚀,负极的电极反应式为______。请在图3中用箭头标出发生该腐蚀时电子流动方向______;此时,碳粉表面发生了______(“氧化”或“还原”)反应。
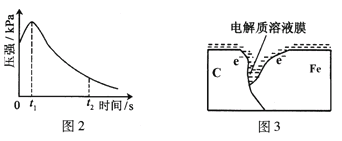
(3)该小组对图2中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:___________________。