题目内容
【题目】H2O2被称为绿色氧化剂,受到人们越来越多的关注。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请问答下列问题:
(1)定性分析:图甲可通过观察____________,定性比较得出结论。有同学提出将FeCl3溶液改为Fe2(SO4)3溶液更合理,其理由是_____________。

(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为_________,检查该装置气密性的方法是:关闭分液漏斗的活塞,将注射器活塞向外拉出一段后松手,过一段时间后看________,实验中需要测量的数据是_______。

(3)课本在研究浓度对反应速率影响的实验中,酸性高锰酸钾和草酸反应的离子方程式为________,反应开始一段时间后反应速率明显提升的原因是____________。
【答案】 产生气泡的快慢 阴离子相同更能说明铁离了和铜离子的催化效果 分液漏斗 关闭A的活塞,将注射器活塞向外拉出一段后松手,若注射器活塞复原说明装置气密性良好 生成40mL气体所需要的时间 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 反应生成锰离子起催化作用
【解析】(1)反应产物有氧气,反应越快,产生的气泡也就越快,可通过观察产生气泡的快慢来判断;两种催化剂中阴离子不同,不能排除是不是氯离子或是硫酸根离子的催化作用,故选用阴离子相同的试剂;
(2)仪器A的名称为分液漏斗;关闭A的活塞,将注射器活塞向外拉出一段后松手,如果系统漏气,活塞将不会回位,若注射器活塞复原说明装置气密性良好;速度指的是单位时间内发生的变化,所以需要测量时间,即测定生成气体达到40mL所需要的时间;
(3)酸性高锰酸钾和岿酸草酸反应的离子方程式为:
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,加快反应速率的因素有增大溶液浓度、反应温度升高、使用催化剂,结合此反应产生气体在短时间反应速率明显提升,只有生成的锰离子起催化作用。

【题目】某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。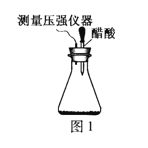
(1)请完成以下实验设计表(表中不要留空格):
编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
② | 醋酸浓度的影响 | 0.5 | ______ | 36.0 |
③ | _________ | 0.2 | 2.0 | 90.0 |
(2)编号①实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了______腐蚀,负极的电极反应式为______。请在图3中用箭头标出发生该腐蚀时电子流动方向______;此时,碳粉表面发生了______(“氧化”或“还原”)反应。
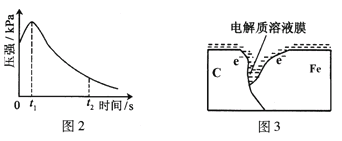
(3)该小组对图2中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:___________________。