题目内容
【题目】下图是铁棒和碳棒在稀硫酸中所组成的原电池装置,c、d为两个电极。下列有关的判断正确的是

A.电池工作的过程中,c电极上产生气泡
B.电池工作时,溶液中H+和Fe2+向d移动
C.d为负极,发生氧化反应
D.电池工作的过程中,溶液中SO![]() 浓度发生显著变化
浓度发生显著变化
【答案】B
【解析】
由电流方向可知,c为负极,d为正极,因铁比碳活泼,则铁为负极,发生氧化反应,电极方程式为Fe-2e-═Fe2+,碳为正极,发生还原反应,电极方程式为2H++2e-═H2↑,以此解答该题.
由电流方向可知,c为负极,d为正极,
A.c为负极,发生氧化反应,电极方程式为Fe-2e-═Fe2+,无气泡产生,故A错误;
B.原电池工作时阳离子向正极移动,即向d极移动,即溶液中H+和Fe2+向d移动,故B正确;
C.d为正极,发生还原反应,故C错误;
D.电池工作的过程中,SO42-不参加电极反应,则溶液中SO42-浓度基本不变,故D错误;
答案选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】四氢铝锂(LiAlH4)常作有机合成的重要还原剂。以辉锂矿(主要成分Li2OAl2O34SiO2,含少量Fe2O3)为原料合成四氢铝锂的流程如图:
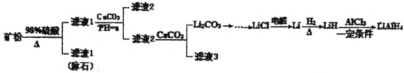
已知:①几种金属氢氧化物沉淀的pH如表所示:
物质 | Fe(OH)3 | A1(OH)3 |
开始沉淀的pH | 2.3 | 4.0 |
完全沉淀的pH | 3.7 | 6.5 |
②常温下,Ksp(Li2CO3)=2.0×10-3。Li2CO3在水中溶解度随着温度升高而减小。
回答下列问题:
(1)上述流程中,提高“酸浸”速率的措施有____ (写两条);加入CaCO3的作用是____,“a”的最小值为____。
(2)用热水洗涤Li2CO3固体,而不用冷水洗涤,其目的是___;检验碳酸锂是否洗净的实验操作是___。
(3)写出LiH和AlCl3反应的化学方程式:___(条件不作要求)
(4)设计简单方案由Li2CO3制备无水LiCl:___。
(5)在有机合成中,还原剂的还原能力通常用“有效氢”表示,其含义是1克还原剂相当于多少克氢气的还原能力,LiAlH4的“有效氢"为___。(结果保留2位小数)

