题目内容
【题目】N2O5是一种新型硝化剂,其性质和制备备受人们的关注。
(1)一定温度下,在2L恒容密闭的容器中充入2.0molN2O5发生反应:2N2O5(g)![]() 4NO2(g)+O2(g)。在三种不同的条件下进行实验,N2O5的浓度随时间的变化如图所示。
4NO2(g)+O2(g)。在三种不同的条件下进行实验,N2O5的浓度随时间的变化如图所示。

①已知:2N2O5(g)===2N2O4(g)+O2(g) △H1=-4.4kJ/mol
2NO2(g)===N2O4(g) △H2=-55.3 kJ/mol
则反应2N2O5(g)===4NO2(g)+O2(g)的△H=________。
②下列不能说明该反应已达平衡状态的是___(填序号)。
A.v正(N2O5)=2v逆(O2)
B.混合气体密度不变
C.混合体平均摩尔质量
D.NO2的体积分数不变
③该反应自发进行的条件是____(填“高温”或“低温”),实验Ⅲ中:a点v逆(O2)____(填“<”或“>”)b点v逆(O2)。
④实验Ⅱ从反应开始至平衡时,v(O2)=____mol/(L·min)。
⑤列式并计算该反应在800℃时的平衡常数K=_______。
(2)1840年Devil用干燥的氯气通过干燥的硝酸银,反应得到N2O5。该反应的氧化产物是一种气体,该反应的化学方程式为_______。
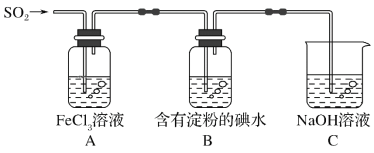
(3)N2O5也可采用“电解法”制备,装置如图所示。

则N2O5在电解池的____(填“阴极”或“阳极”)室生成,其电极反应式为_____。
【答案】+106.2kJ/mol AB 高温 < 0.0125 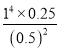 (mol/L)3=1(mol/L)3 2C12+4AgNO3===4AgCl+2N2O5+O2 阳极 N2O4-2e-+2HNO3===2N2O5+2H+
(mol/L)3=1(mol/L)3 2C12+4AgNO3===4AgCl+2N2O5+O2 阳极 N2O4-2e-+2HNO3===2N2O5+2H+
【解析】
(1)①根据题目已知条件:2N2O5(g)===2N2O4(g)+O2(g) △H1=-4.4kJ/mol 为a式,2NO2(g)===N2O4(g) △H2=-55.3 kJ/mol为b式, 则反应2N2O5(g)===4NO2(g)+O2(g)为c式;根据盖斯定律,a-2b=c,所以△H=△H1-2△H2=-4.4kJ/mol-2×(-55.3kJ/mol)=+106.2kJ/mol
②A.根据判断达到平衡状态的依据,不同物质的反应速率之比=化学反应计量系数之比,可判定反应达到平衡,v正(N2O5):v逆(O2)=1:2,即2v正(N2O5)=v逆(O2),A错误;
B.反应体系为恒容体系,体积不变,根据反应2N2O5(g)===4NO2(g)+O2(g)遵循质量守恒,反应前后气体总质量不变,因此反应体系气体密度不变,不能作为平衡依据,B错误;
C.当体系气体平均摩尔质量不在变化,反应达到平衡状态,C正确;
D.反应前后气体不相等的体系,体积分数不在变化,反应达到平衡状态,D正确。
故答案为A、B。
③该平衡体系正反应为吸热,△H>0,正反应方向是气体体积增大的方向,△S>0, 当△H-T△S<0时反应能自发进行,则反应能否进行取决于T,且T值大时,△H-T△S<0。具备该条件的反应,在高温时能自发进行,在低温时不能自发进行。故答案为高温;
实验Ⅲ中:a点到b点N2O5的浓度减小,反应正向进行,容器体积不变,O2的浓度逐渐增大,由于浓度越大,反应速率越快,因此a点v逆(O2)<b点v逆(O2)。
④v(N2O5)=![]() mol/(L·min)=0.025mol/(L·min),v(O2)=
mol/(L·min)=0.025mol/(L·min),v(O2)=![]() ×0.025mol/(L·min)= 0.0125mol/(L·min)。
×0.025mol/(L·min)= 0.0125mol/(L·min)。
⑤用“三段式”求得平衡时c(N2O5)=0.5mol/L,c(NO2)=1mol/L,c(O2)=0.25mol/L,因此,K=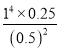 (mol/L)3=1(mol/L)3。
(mol/L)3=1(mol/L)3。
(2)氯气在反应中得到电子作氧化剂,硝酸银中只有氧元素化合价会升高,所以氧化产物是氧气,化学反应方程式为2Cl2+4AgNO3===4AgCl+2N2O5+O2
(3)从电解原理来看,N2O4制备N2O5为氧化反应,则N2O5应在阳极区生成,反应式为N2O4-2e-+2HNO3===2N2O5+2H+,故答案为:阳极,N2O4-2e-+2HNO3===2N2O

【题目】采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题
(1)1840年 Devil用干燥的氯气通过干燥的硝酸银,得到N2O5。该反应的氧化产物是一种气体,其分子式为___________。
(2)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:

其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O4(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5. | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
①已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH1=4.4 kJ·mol1
2NO2(g)=N2O4(g) ΔH 2=55.3 kJ·mol1
则反应N2O5(g)=2NO2(g)+ ![]() O2(g)的ΔH=_______ kJ·mol1。
O2(g)的ΔH=_______ kJ·mol1。
②研究表明,N2O5(g)分解的反应速率![]() 。t=62 min时,测得体系中
。t=62 min时,测得体系中![]() pO2=2.9 kPa,则此时的
pO2=2.9 kPa,则此时的![]() =________kPa,v=_______kPa·min1。
=________kPa,v=_______kPa·min1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于”或“小于”),原因是________。
④25℃时N2O4(g)![]() 2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
(3)对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步 N2O5![]() NO2+NO3 快速平衡
NO2+NO3 快速平衡
第二步 NO2+NO3→NO+NO2+O2 慢反应
第三步 NO+NO3→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是_______(填标号)。
A.v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效
D.第三步反应活化能较高