题目内容
 A、B、C、D、E、F六种短周期元素,原子序数依次增大,A和E同主族,A元素的原子半径最小,B元素形成的化合物目前在所有元素中种类最多,D元素原子的最外层电子数是内层电子数的3倍,A元素和F元素可形成共价化合物AF,其水溶液呈酸性.
A、B、C、D、E、F六种短周期元素,原子序数依次增大,A和E同主族,A元素的原子半径最小,B元素形成的化合物目前在所有元素中种类最多,D元素原子的最外层电子数是内层电子数的3倍,A元素和F元素可形成共价化合物AF,其水溶液呈酸性.请回答下列问题:
(1)写出下列元素的名称:C
(2)上述六种元素中,第一电离能量小的元素是
(3)A单质和D单质可形成燃料电池提供电能,请写出碱性条件下的正极电极反应式:
(4)A元素和B元素可形成自然界最简单的有机物,常温常压下,4g该有机物完全燃烧可放出222.4kJ的热量,请写出该有机物燃烧的热化学方程式:
(5)A、C、F可形成离子化合物G,G的水溶液呈弱酸性,请写出G的水溶液中各离子浓度由大到小的顺序:
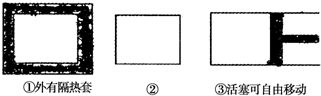
(6)如图所示,三个容积相同的容器①②③,若起始温度相同,分别向三个容器中充入3molA2和1molC2;一定条件下反应,达到平衡时各容器中CA3的百分含量由大到小的顺序为
分析:A、B、C、D、E、F六种短周期元素,原子序数依次增大,B元素形成的化合物目前在所有元素中种类最多,则B为C元素;D元素原子的最外层电子数是内层电子数的3倍,D原子只能有2个电子层,最外层电子数为6,则D为O元素;C原子序数介于碳与氧元素之间,则C为N元素;A和E同主族,A元素的原子半径最小,则A为H元素,E的原子序数等于O,则E为Na;A元素和F元素可形成共价化合物AF,其水溶液呈酸性,F为-1价,处于ⅦA族,原子序数最大,则F为Cl,据此解答.
解答:解:A、B、C、D、E、F六种短周期元素,原子序数依次增大,B元素形成的化合物目前在所有元素中种类最多,则B为C元素;D元素原子的最外层电子数是内层电子数的3倍,D原子只能有2个电子层,最外层电子数为6,则D为O元素;C原子序数介于碳与氧元素之间,则C为N元素;A和E同主族,A元素的原子半径最小,则A为H元素,E的原子序数等于O,则E为Na;A元素和F元素可形成共价化合物AF,其水溶液呈酸性,F为-1价,处于ⅦA族,原子序数最大,则F为Cl,
(1)由上述分析可知:C为氮、F为氯,故答案为:氮;氯;
(2)上述六种元素中,只有Na为金属,其第一电离能量小,基态原子s轨道上所有电子数和p轨道上电子数相等的是碳元素,其原子核外电子排布式为1s22s22p4,
故答案为:Na;1s22s22p4;
(3)氢气和氧气可形成燃料电池提供电能,正极发生还原反应,氧气正极获得电子,碱性条件下生成氢氧根离子,正极电极反应式为:O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(4)H元素和C元素可形成自然界最简单的有机物为CH4,常温常压下,4g该有机物完全燃烧可放出222.4kJ的热量,则1mol甲烷燃烧放出的热量为222.4kJ×
=889.6kJ,甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(1)H=-889.6kJ/mol,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(1)H=-889.6kJ/mol;
(5)H、N、Cl可形成离子化合物G为NH4Cl,NH4Cl的水溶液中NH4+水解NH4++H2O?NH3?H2O+H+,溶液呈弱酸性,水解沉淀不大铵根离子浓度远大于氢离子浓度,故水溶液中各离子浓度由大到小的顺序:c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(6)氢气与氮气合成氨气为气体体积减小的放热反应,如图所示,三个容积相同的容器①②③,①为恒容且温度升高,②为恒温恒容,③为恒温恒压,①的平衡可以等效为在②的平衡基础上升高温度,平衡向逆反应方向移动,则NH3的百分含量②>①,②的平衡可以等效为在③的平衡基础上增大压强,平衡向逆反应方向移动,则NH3的百分含量③>②,故NH3的百分含量③>②>①,
故答案为:③>②>①.
(1)由上述分析可知:C为氮、F为氯,故答案为:氮;氯;
(2)上述六种元素中,只有Na为金属,其第一电离能量小,基态原子s轨道上所有电子数和p轨道上电子数相等的是碳元素,其原子核外电子排布式为1s22s22p4,
故答案为:Na;1s22s22p4;
(3)氢气和氧气可形成燃料电池提供电能,正极发生还原反应,氧气正极获得电子,碱性条件下生成氢氧根离子,正极电极反应式为:O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(4)H元素和C元素可形成自然界最简单的有机物为CH4,常温常压下,4g该有机物完全燃烧可放出222.4kJ的热量,则1mol甲烷燃烧放出的热量为222.4kJ×
| 1mol×16g/mol |
| 4g |
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(1)H=-889.6kJ/mol;
(5)H、N、Cl可形成离子化合物G为NH4Cl,NH4Cl的水溶液中NH4+水解NH4++H2O?NH3?H2O+H+,溶液呈弱酸性,水解沉淀不大铵根离子浓度远大于氢离子浓度,故水溶液中各离子浓度由大到小的顺序:c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(6)氢气与氮气合成氨气为气体体积减小的放热反应,如图所示,三个容积相同的容器①②③,①为恒容且温度升高,②为恒温恒容,③为恒温恒压,①的平衡可以等效为在②的平衡基础上升高温度,平衡向逆反应方向移动,则NH3的百分含量②>①,②的平衡可以等效为在③的平衡基础上增大压强,平衡向逆反应方向移动,则NH3的百分含量③>②,故NH3的百分含量③>②>①,
故答案为:③>②>①.
点评:本题较综合,涉及结构性质位置关系应用、核外电子排布、原电池、热化学方程式、盐类水解、化学平衡影响因素等,难度中等,(6)中关键是利用等效思想构造平衡建立的途径便于比较.

练习册系列答案
相关题目
 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.