题目内容
【题目】CH4是一种清洁、高效、具有优良的环保性能的燃料,其燃烧热为890.3KJ·mol-1。它可以作为燃料电池的燃料。
(1)写出甲烷燃烧的热化学方程式:________;
(2)已知H2(g)和C(S)的燃烧热分别是285.8kJ·mol-1、393.5kJ·mol-1;则反应C(S)+ 2H2(g)=CH4(g)的反应热⊿H=______________;
(3)以甲烷、空气、氢氧化钾溶液为原料,惰性电极为电极可以构成燃料电池。该电池的负极反应式为:___________________;
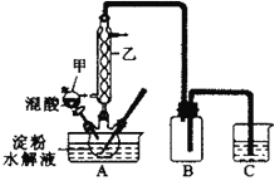
(4)用(3)中的燃料电池为电源,以石墨为电极电解500mL滴有酚酞的NaCl溶液,装置如图所示:
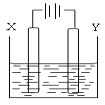
①请写出电解过程中阴极附近观察到的现象:___________________。
②到燃料电池消耗2.8LO2(标准状况下)时,计算此时NaCl溶液的pH=____(假设溶液的体积不变,气体全部从溶液中逸出)。
在Y极通过的电子的物质的量为:______________。
③电解之后,要使溶液恢复原状,应该向溶液中加入物质_____(填名称),溶液中Cl―流向___极(填“X”或“Y”)。
【答案】CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol(其他合理答案亦可) -74.8kJ/mol CH4-8e-+10OH-=CO32-+7H2O 有无色气泡产生,同时阴极附近溶液由无色变红色 14 0.5mol 氯化氢气体 X
【解析】
(1)依据热化学方程式的书写方法,结合燃烧热的概念是1mol可燃物完全燃烧生成稳定氧化物时放出的热量写出,注意标注物质的聚集状态和燃烧热;
(2)根据燃烧热写出热化学方程式,再利用盖斯定律来计算;
(3)先判断氧化剂、还原剂,然后根据原电池原理判断正负极上反应的物质,结合电解质溶液写出电极反应式;
(4)依据电源判断X为电解池的阳极,Y为电解池的阴极;
①阴极是溶液中的氢离子得到电子生成氢气,溶液中水的电离被破坏,生成了氢氧根离子显碱性,遇酚酞变红;
②根据甲烷燃料电池的电极反应和电解氯化钠的电极反应,依据电子守恒计算得到;电极上的电子转移守恒;
③依据电解氯化钠溶液生成了氢气、氯气和氢氧化钠,恢复原溶液浓度需要加入氢气和氯气组成的氯化氢;电解过程中阴离子移向阳极。
(1)CH4是一种清洁、高效、具有优良的环保性能的燃料,其燃烧热为890.3kJmol-1,热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol(其他合理答案亦可)。
(2)25℃、101kPa下,H2(g)、C(s)的燃烧热分别是285.8kJmol-1、393.5kJmol-1;则①H2(g)+![]() O2(g)=H2O(l)△H=-285.8kJmol-1;②C(s)+O2(g)=CO2(g)△H=-393.5kJmol-1;③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol;依据盖斯定律,①×2+②-③得到:C(S)+2H2(g)=CH4(g)△H=-74.8kJ/mol;
O2(g)=H2O(l)△H=-285.8kJmol-1;②C(s)+O2(g)=CO2(g)△H=-393.5kJmol-1;③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol;依据盖斯定律,①×2+②-③得到:C(S)+2H2(g)=CH4(g)△H=-74.8kJ/mol;
故答案为:-74.8kJ/mol。
(3)负极上的电极反应式等于电池的总反应式-正极发生的电极方程式;以甲烷、空气、氢氧化钾溶液为原料,惰性电极可构成燃料电池,正极反应为:3O2+12H2O+12e-=12OH-,总反应式为:CH4+2O2+2OH-=CO32-+3H2O,两式相减,负极反应为:CH4-8e-+10OH-=CO32-+7H2O,
故答案为:CH4-8e-+10OH-=CO32-+7H2O。
(4)燃料电池为电源,以石墨为电极电解500mL滴有酚酞的NaCl溶液,X为电解池的阳极,Y为电解池的阴极;
①阴极是溶液中的氢离子得到电子生成氢气,溶液中水的电离被破坏,生成了氢氧根离子显碱性,遇酚酞变红;电解过程中阴极附近观察到的现象是:有无色气泡产生,同时阴极附近溶液由无色变红色;
故答案为:有无色气泡产生,同时阴极附近溶液由无色变红色。
②甲烷燃料电池的正极消耗氧气,燃料电池消耗2.8LO2物质的量=2.8L÷22.4L/mol=0.125mol;正极反应为:3O2+12H2O+12e-=12OH-,计算得到电子转移为0.5mol;电解氯化钠溶液阴极电极反应为:2H++2e-=H2↑,根据水电离出的氢氧根离子和氢离子守恒,溶液中减少的氢离子和增加的氢氧根离子相同,计算得到生成氢氧根离子物质的量为0.5mol,c(OH-)=0.5mol/0.5L=1mol/L;所以溶液pH=14;电极上的电子守恒得到在Y极通过的电子的物质的量为0.5mol;
故答案为:14;0.5mol。
③电解氯化钠溶液生成了氢气、氯气和氢氧化钠,恢复原溶液浓度需要加入氢气和氯气组成的氯化氢气体;电解过程中阴离子移向阳极;故答案为:氯化氢气体;X。

 阅读快车系列答案
阅读快车系列答案【题目】2019年3月8日,联合国妇女署在推特上发布了一张中国女科学家屠呦呦的照片。致敬她从传统中医药中找到了治疗疟疾的药物----青蒿素。
已知:青蒿素是烃的含氧衍生物,为无色针状晶体。乙醚沸点为35℃。
(1)我国提取中草药有效成分的常用溶剂有:水;或亲水性溶剂(如乙醇,与水互溶);或亲脂性溶剂(如乙醚,与水不互溶)。诺贝尔奖获得者屠呦呦及其团队在提取青蒿素治疗疟疾过程中,记录如下:“青蒿素的水煎剂无效;乙醇提取物的效用为30%~40%;乙醚提取物的效用为95%”。下列推测不合理的是_____;
A | 青蒿素在水中的溶解度很大 | B | 青蒿素含有亲脂的官能团 |
C | 在低温下提取青蒿素,效果会更好 | D | 乙二醇提取青蒿素的能力强于乙醚 |
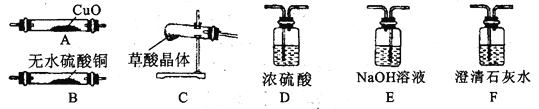
(2)用下列实验装置测定青蒿素实验式的方法如下:
将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。
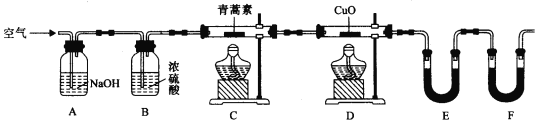
①装置D的作用是______,装置E中吸收的物质是______,装置F中盛放的物质是______。
②实验装置可能会产生误差,造成测定含氧量偏低,改进方法是______。
③合理改进后的装置进行实验,称得:
装置 | 实验前/g | 实验后/g |
E | 22.6 | 42.4 |
F | 80.2 | 146.2 |
则测得青蒿素的实验式是_____。