题目内容
【题目】常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列叙述正确的是( )
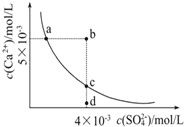
①a、c两点均可以表示CaSO4溶于水所形成的饱和溶液
②a点对应的Ksp不等于c点对应的Ksp
③b点对应的溶液将有沉淀生成
④d点溶液通过蒸发溶剂可以变到c点
⑤常温下CaSO4溶于水的饱和溶液中,c(Ca2+)与c(SO42-)的乘积对应曲线上任意一点
⑥常温下,向100 mL饱和CaSO4溶液中加入400 mL0.01 mol/L Na2SO4溶液,能使溶液由a点变为b点
A.2句B.3句C.4句D.5句
【答案】A
【解析】
①曲线上的点为饱和溶液的沉淀溶解平衡状态;
②曲线上表示达到沉淀溶解平衡,Ksp只随温度而改变;
③根据Qc与Ksp关系判断有无沉淀生成;
④蒸发溶剂,溶液中SO42-浓度变大;
⑤CaSO4溶于水的饱和溶液中,溶液中c(Ca2+)=c(SO42-);
⑥饱和溶液中加入Na2SO4溶液,开始时不在a点。
①曲线上的点为饱和溶液的平衡状态,①正确;
②Ksp是一常数,温度不变Ksp不变,在曲线上的任意一点Ksp都相等,所以a、c两点的Ksp相等,②错误;
③根据图示数据,可以看出b点Qc=2×l0-5>Ksp,所以会生成沉淀,③正确;
④d为不饱和溶液,蒸发溶剂时,溶液中SO42-、Ca2+的浓度都会增大,d点溶液不可能通过蒸发溶剂变到c点,④错误;
⑤常温下CaSO4溶于水的饱和溶液中,c(Ca2+)=c(SO42-)=3×10-3 mol/L,⑤错误;
⑥CaSO4饱和溶液c(Ca2+)=c(SO42-)=3×10-3 mol/L,开始不在a点,加入400 mL0.01 mol/LNa2SO4溶液后,c(Ca2+)=0.6×10-3mol/L,c(SO42-)=8.6×10-3mol/L,Qc<Ksp,没有沉淀生成,此时为不饱和溶液,⑥错误;
综合以上分析①③正确,正确的有2个,故合理选项是A。

【题目】已知下表为![]() 时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是( )
时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是( )
| HClO |
|
|
|
|
A.向NaClO溶液中通入少量二氧化碳的离子方程式为:![]()
B.相同浓度的![]() 和NaClO的混合溶液中,
和NaClO的混合溶液中,![]()
C.向![]() 溶液中加入少量水,溶液中pH增大
溶液中加入少量水,溶液中pH增大
D.25℃时,![]() 溶液通入
溶液通入![]() 至溶液的
至溶液的![]() 时,溶液中:
时,溶液中:![]()