题目内容
【题目】下列说法中不正确的是( )
A.浓度均为0.1 molL-1的小苏打溶液与烧碱溶液等体积混合:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-)
B.pH相同的盐酸和硫酸,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液pH相等,则m>n
C.常温下,0.1 molL-1某一元酸HA在水中有0.1%发生电离,则该温度下HA的电离常数约为10-7
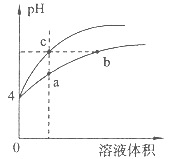
D.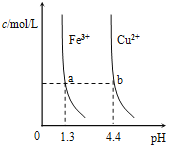 某温度下,Fe(OH)3,Cu(OH)2分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度的变化如图。由图可知:Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
某温度下,Fe(OH)3,Cu(OH)2分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度的变化如图。由图可知:Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
【答案】B
【解析】
A.浓度相等体积相等的小苏打溶液与烧碱溶液混合,二者恰好反应产生Na2CO3,根据电荷守恒可知:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-),A正确;
B.盐酸、硫酸都是强酸,完全电离,pH相同的盐酸和硫酸,溶液中c(H+)相等,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液pH相等,说明稀释后溶液中c(H+)仍然相等,因此稀释倍数m=n,B错误;
C. HA是一元弱酸,在溶液中存在电离平衡,由HA![]() H++A-,在常温下,0.1 molL-1某一元酸HA在水中有0.1%发生电离,则c(H+)=c(A-)=0.1 mol/L×0.1%=10-4 mol/L,c(HA)=0.1 mol/L-10-4 mol/L≈0.1 mol/L,所以该弱酸在常温下的电离平衡常数为K=
H++A-,在常温下,0.1 molL-1某一元酸HA在水中有0.1%发生电离,则c(H+)=c(A-)=0.1 mol/L×0.1%=10-4 mol/L,c(HA)=0.1 mol/L-10-4 mol/L≈0.1 mol/L,所以该弱酸在常温下的电离平衡常数为K=![]() =1×10-7,C正确;
=1×10-7,C正确;
D.Ksp[Fe(OH)3]=c(Fe3+)·c3(OH-)= c(Fe3+)· (10-12.7) 3;Ksp[Cu(OH)2]= c(Cu2+)·c2(OH-)= c(Cu2+)· (10-9.6)2;由于c(Fe3+)=c(Cu2+),所以Ksp[Fe(OH)3]< Ksp[Cu(OH)2],D正确;
故合理选项是B。

 53随堂测系列答案
53随堂测系列答案