��Ŀ����
����Ŀ���Ҷ��ᣨHOOC��COOH���ɼ�дΪH2C2O4���׳Ʋ��ᣬ��100�濪ʼ������157��ʱ��ʼ�ֽ⣮
(1)̽�����������
����֪��25��H2C2O4�ĵ��볣�� K1=5.4��10-2��K2=5.4��10-5��H2CO3�ĵ��볣�� K1=4.5��10-7��K2=4.7��10-11�������л�ѧ����ʽ��ȷ����___����ѡ����ţ���ͬ��
A��H2C2O4+CO32-=HCO3-+HC2O4- B��HC2O4-+CO32-=HCO3-+C2O42-
C��H2O+CO2+C2O42-=HC2O4-+HCO3- D��C2O42-+CO2+H2O=H2C2O4+CO32-
����1L 0.02mol/L H2C2O4��Һ�еμ�1L 0.01mol/L NaOH��Һ�������Һ��c��H+����c��OH����������˵������ȷ����___��
A��c��H2C2O4����c��HC2O4-��
B��c��Na+��+c��H+��=2c��C2O42-��+c��HC2O4-��+c��OH����
C��c��OH����=c��H+��+2c��H2C2O4��+c��HC2O4-��
D��c��H2C2O4��+c��C2O42-��+c��HC2O4-��=0.02mol/L
(2)������KMnO4��Һ�ζ������ʵ�Na2C2O4��Ʒ����֪���ʲ���KMnO4��H2SO4��Һ��Ӧ����
ʵ�鲽�裺ȷ��ȡ1g��ƷNa2C2O4���壬���100mL��Һ��ȡ��20.00mL����ƿ�У�����ƿ�м�������ϡH2SO4��Һ����0.016mol/L���������Һ�ζ����ζ����յ�ʱ���ĸ��������Һ25.00mL������֪��5H2C2O4+2KMnO4+3H2SO4=10CO2��+2MnSO4+K2SO4+8H2O��
���������ҺӦװ��__________�ζ����С���������ʽ��������ʽ����
�ڵζ����յ�ʱ��ʵ�������ǣ�__________________________________________��
�����в�������ʹ�������ƫ�ߵ���_____________��
A��ʢװ��Na2C2O4�ĵζ���û��ϴ
B��ʢװ���������Һ�ĵζ��ܵζ�ǰ���촦�����ݣ��ζ���������ʧ
C������ʱ�ζ�ǰ���ӣ��ζ����� D����ƿ�в�������ˮ
�ܼ�����Ʒ��Na2C2O4�Ĵ���____________________��
���𰸡�B B ��ʽ ��ɫ��Ϊdz��ɫ��dz�Ϻ�ɫ�����Ұ�����ڲ���ɫ B 67%
��������
(1)�ٸ��ݲ����̼��ĵ���ƽ�ⳣ���ж�����ǿ����Ȼ������ǿ���û������ԭ�������жϣ�
��A����Һ��ʾ���ԣ�˵������ĵ���̶ȴ��ڲ���������ӣ�
B��������Һ�еĵ���غ��жϣ�
C��������Һ��ʾ���Է�����
D��������Һ�е������غ��жϣ�
(2)�ٸ������Ը��������ҺΪ���ԡ�����ǿ�����Է�����
�ڸ��ݵζ�����ǰΪ��ɫ���ζ�������Ϊdz��ɫ�жϵζ��յ㣻
�۷�����ӦΪ2MnO4-+5C2O42-+16H+=10CO2��+2Mn2++8H2O�����ݵζ�������c=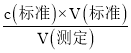 ��Ӱ�������
��Ӱ�������
���ȼ����20mL��Ʒ��Һ���ĸ�����ص����ʵ������ټ����100mL��Ʒ��Һ���ĸ�����ص����ʵ�����Ȼ����ݷ�Ӧ��������IJ����Ƶ����ʵ���������m=nM�����1g��������Ʒ�к��в����Ƶ����������������Ʒ�Ĵ��ȡ�
(1)����25��H2C2O4 K1=5.4��10��2��K2=5.4��10��5��H2CO3 K1=4.5��10��7��K2=4.7��10��11��֪���Դ�СΪ��H2C2O4��HC2O4����H2CO3��HCO3����
��A������HC2O4����H2CO3���������̼������ӷ�Ӧ���ɶ�����̼����Ͳ�������ӣ���ȷ�ķ�ӦΪ��H2C2O4+CO32��=CO2��+H2O+C2O42������A����
B��HC2O4����H2CO3��HCO3�������������������ʱ��������Ӧ��HC2O4��+CO32��=HCO3��+C2O42������B��ȷ��
C������HC2O4����H2CO3����Ӧ��H2O+CO2+C2O42��=HC2O4��+HCO3�����ᷢ�����ʴ���
D������HC2O4����H2CO3��̼�����û������ᣬ�÷�ӦC2O42��+CO2+H2O�TH2C2O4+CO32�����ᷢ������D����
�ʴ�ΪB��
����1L 0.02mol/L H2C2O4��Һ�еμ�1L 0.01mol/L NaOH��Һ����Ӧ������Ϊ��Ũ�ȵ�H2C2O4��NaHC2O4�������Һ��c(H+)��c(OH��)��
A������ĵ���̶ȴ���HC2O4���ĵ��룬����Һ��c(H2C2O4)��c(HC2O4��)����A����
B�����ݵ���غ�ɵã�c(Na+)+c(H+)�T2c(C2O42��)+c(HC2O4��)+c(OH��)����B��ȷ��
C����Һ�����ԣ�c(OH��)��c(H+)����c(OH��)��c(H+)+2c(H2C2O4)+c(HC2O4��)����C����
D�����������غ�ɵã�c(H2C2O4)+c(C2O42��)+c(HC2O4��)=0.01mol/L����D����
�ʴ�ΪB��
(2)�����Ը��������Һ�����ԣ��Ҿ���ǿ�����ԣ��ܹ�������ʽ�ζ��ܵ��ܣ�����Ӧ������ʽ�ζ�����ȡ��
�ڵζ�����ǰ��ҺΪ��ɫ���ζ���������Һ��dz��ɫ�����Եζ��յ������Ϊ����ɫ��Ϊdz��ɫ(��dz�Ϻ�ɫ)���Ұ�����ڲ���ɫ��
��A��ʢװ��Na2C2O4�ĵζ���û��ϴ�����´���ҺŨ�ȼ�С����ⶨ���ƫС����A����
B��ʢװ���������Һ�ĵζ��ܵζ�ǰ���촦�����ݣ��ζ���������ʧ���������ĵı�Һ���ƫ�ⶨ���ƫ�ߣ���B��ȷ��
C������ʱ�ζ�ǰ���ӣ��ζ����ӣ������ĸ��������Һ���ƫС���ⶨ���ƫ�ͣ���C����
D����ƿ�в�������ˮ���Բⶨ�����Ӱ�죬��D����
�ʴ�ΪB��
��25.00mL 0.016mol/L���������Һ�к��и�����ص����ʵ���Ϊ��0.016mol/L��0.025L=0.0004mol��100mL����Ʒ��Һ��ȫ��Ӧ���ĸ�����ص����ʵ���Ϊ��0.0004mol��5=0.002mol�����ݷ�Ӧ2MnO4��+5C2O42��+16H+=10CO2��+2Mn2++8H2O��֪��1gNaspan>2C2O4������Ʒ�к��в����Ƶ����ʵ���Ϊ��0.002mol��![]() =0.005mol������Ϊ��134g/mol��0.005mol=0.67g������Na2C2O4�Ĵ���Ϊ��
=0.005mol������Ϊ��134g/mol��0.005mol=0.67g������Na2C2O4�Ĵ���Ϊ��![]() ��100%=67%��
��100%=67%��