ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩΜ·―ß÷–≥Θ”ΟΆΦœσ÷±ΙέΒΊΟη ωΜ·―ßΖ¥”ΠΒΡΫχ≥ΧΜρΫαΙϊΓΘœ¬Ν–ΆΦœσΟη ω’ΐ»ΖΒΡ «Θ® Θ©
A. ΗυΨίΆΦΔΌΘ§Ω…≈–ΕœΩ…ΡφΖ¥”ΠA2(g)+3B2(g)
ΗυΨίΆΦΔΌΘ§Ω…≈–ΕœΩ…ΡφΖ¥”ΠA2(g)+3B2(g)![]() 2AB3(g)’ΐΖ¥”Π «Έϋ»»Ζ¥”Π
2AB3(g)’ΐΖ¥”Π «Έϋ»»Ζ¥”Π
B. ΆΦΔΎ±μ Ψ≤ΜΆ§―Ι«ΩΕ‘Ω…ΡφΖ¥”Π2A(g)+2B(g)
ΆΦΔΎ±μ Ψ≤ΜΆ§―Ι«ΩΕ‘Ω…ΡφΖ¥”Π2A(g)+2B(g)![]() 3C(g)+D(s)ΒΡ”Αœλ
3C(g)+D(s)ΒΡ”Αœλ
C. ΆΦΔέΩ…±μ Ψ““Υα»ή“Κ÷–Ά®»κΑ±Τχ÷ΝΙΐΝΩΙΐ≥Χ÷–»ή“ΚΒΦΒγ–‘ΒΡ±δΜ·
ΆΦΔέΩ…±μ Ψ““Υα»ή“Κ÷–Ά®»κΑ±Τχ÷ΝΙΐΝΩΙΐ≥Χ÷–»ή“ΚΒΦΒγ–‘ΒΡ±δΜ·
D. ΗυΨίΆΦΔή»ήΫβΕ»”κ»ή“ΚpHΙΊœΒΘ§”ΟCuOΒςΫΎCuSO4»ή“ΚΒΡpH÷Ν4Ήσ”“Θ§≥ΐ»Ξ»ή“Κ÷–ΒΡFe3+
ΗυΨίΆΦΔή»ήΫβΕ»”κ»ή“ΚpHΙΊœΒΘ§”ΟCuOΒςΫΎCuSO4»ή“ΚΒΡpH÷Ν4Ήσ”“Θ§≥ΐ»Ξ»ή“Κ÷–ΒΡFe3+
ΓΨ¥πΑΗΓΩD
ΓΨΫβΈωΓΩ
A. ΗυΨίΆΦœσΩ…÷ΣΘ§Έ¬Ε»…ΐΗΏΘ§ΡφΖ¥”ΠΥΌ¬ ¥σ”Ύ’ΐΖ¥”ΠΥΌ¬ Θ§ΥΒΟς…ΐΗΏΈ¬Ε»Μ·―ßΤΫΚβœρΈϋ»»ΒΡΡφΖ¥”ΠΖΫœρ“ΤΕ·Θ§‘ρΗΟΖ¥”ΠΒΡ’ΐΖ¥”ΠΈΣΖ≈»»Ζ¥”ΠΘ§Φ¥ΓςH<0Θ§A¥μΈσΘΜ
B. ¥”ΆΦœσΩ…÷ΣΘ§―Ι«ΩΈΣP2ΒΡΖ¥”ΠΒΫ¥οΤΫΚβ”ΟΒΟ ±Φδ…ΌΘ§‘ρΤδΖ¥”ΠΥΌ¬ ΩλΘ§―Ι«Ω‘Ϋ¥σΖ¥”ΠΥΌ¬ ‘Ϋ¥σΘ§Ι ―Ι«ΩP2>P1Θ§ΗυΨίΖ¥”ΠΖΫ≥Χ ΫΩ…“‘Ω¥≥ωΘ§Έο÷ DΈΣΙΧΧεΘ§”…”ΎΗΟΖ¥”ΠΒΡ’ΐΖ¥”ΠΈΣΤχΧεΧεΜΐΦθ–ΓΒΡΖ¥”ΠΘ§‘ω¥σ―Ι«ΩΤΫΚβœρ’ΐΖ¥”ΠΖΫœρ“ΤΕ·Θ§Β±¥οΒΫΤΫΚβ ±Ζ¥”ΠΈοAΒΡΚ§ΝΩΦθ–ΓΘ§ΕχΆΦ÷–¥οΒΫΤΫΚβ ±Ζ¥”ΠΈοAΒΡΈο÷ ΒΡΝΩ‘ΎΝΫ÷÷≤ΜΆ§―Ι«Ωœ¬œύΆ§Θ§≤ΜΖϊΚœ ΒΦ Θ§B¥μΈσΘΜ
C. ““ΥαΚΆΑ±Υ°ΕΦΈΣ»θΒγΫβ÷ Θ§Ζ¥”ΠΩΣ Φ ±»ή“Κ÷–άκΉ”≈®Ε»–ΓΘ§ΒΦΒγΡήΝΠ»θΘ§Β±Εΰ’ΏΖ¥”Π ±…ζ≥…ΒΡ¥ΉΥαοßΈΣ«ΩΒγΫβ÷ Θ§ Ι»ή“Κ÷–άκΉ”≈®Ε»‘ω¥σΘ§ΒΦΒγ–‘‘ω«ΩΘ§Κσ‘ΌΦ”»κΑ±Υ°Θ§œύΒ±”ΎΕ‘¥ΉΥαοß»ή“ΚΤπœΓ ΆΉς”ΟΘ§ Ι»ή“Κ÷–άκΉ”≈®Ε»Φθ–ΓΘ§ΒΦΒγ–‘Φθ»θΘ§C¥μΈσΘΜ
D. CuSO4 ««ΩΥα»θΦν―ΈΘ§Υ°Ϋβ Ι»ή“Κœ‘Υα–‘Θ§Β±œρ»ή“Κ÷–Φ”»κ ΝΩCuO ±Θ§ΖΔ…ζΘΚCuO+2H+=Cu2++H2OΘ§»ή“Κ÷–H+≈®Ε»Φθ–ΓΘ§¥οΒΫFe3+…ζ≥…≥ΝΒμΒΡpH÷Β4Ήσ”“ ±Θ§ΨΆ–Έ≥…Fe(OH)3≥ΝΒμΘ§¥”Εχ¥οΒΫ≥ΐ»Ξ»ή“Κ÷–ΒΡFe3+ΒΡΡΩΒΡΘ§D’ΐ»ΖΘΜ
Ι Κœάμ―Γœν «DΓΘ

 ΟœΫ®ΤΫ–Γ―ßΙωΕ·≤β ‘œΒΝ–¥πΑΗ
ΟœΫ®ΤΫ–Γ―ßΙωΕ·≤β ‘œΒΝ–¥πΑΗ ΜΤΗ‘ΧλΧλΝΖΩΎΥψΧβΩ®œΒΝ–¥πΑΗ
ΜΤΗ‘ΧλΧλΝΖΩΎΥψΧβΩ®œΒΝ–¥πΑΗΓΨΧβΡΩΓΩΈΣ”––ßΩΊ÷ΤΈμω≤Θ§ΗςΒΊΜΐΦΪ≤…»Γ¥κ ©ΗΡ…Τ¥σΤχ÷ ΝΩΓΘΤδ÷–Θ§ΩΊ÷ΤΩ’Τχ÷–ΒΣ―θΜ·ΈοΚΆΝρ―θΜ·ΈοΒΡΚ§ΝΩ”»ΈΣ÷Ί“ΣΓΘ
(1)ΟΚ»Φ…’≤ζ…ζΒΡ―ΧΤχ÷–Κ§”–ΒΣΒΡ―θΜ·Έο,”ΟCH4¥ΏΜ·ΜΙ‘≠NO2Ω…œϊ≥ΐΒΣ―θΜ·ΈοΒΡΈέ»ΨΓΘ“―÷ΣΘΚ
ΔΌCH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΓςH= -867.0kJ/molΘΜ
ΔΎN2(g)+2O2(g)=2NO2(g) ΓςH=+67.8kJ/molΘΜ
ΔέN2(g)+O2(g)=2NO(g) ΓςH=+89.0kJ/mol
‘ρCH4¥ΏΜ·ΜΙ‘≠NOΒΡ»»Μ·―ßΖΫ≥Χ ΫΈΣ_______ΓΘ
(2)ΫΪ0.20mol NOΚΆ0.10mol CO≥δ»κ“ΜΗωΈ¬Ε»ΚψΕ®ΓΔ»ίΜΐΚψΈΣ2LΒΡΟή±’»ίΤς÷–ΖΔ…ζΖ¥”Π2NO(g)+2CO(g)=N2(g)+2CO2(g)Θ§Ω… Βœ÷ΒΣ―θΜ·ΈοΒΡΉΣΜ·Θ§Ζ¥”ΠΙΐ≥Χ÷–≤ΩΖ÷Έο÷ ΒΡΈο÷ ΒΡΝΩ±δΜ·»γΆΦΥυ ΨΓΘ
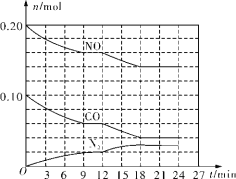
ΔΌN2‘Ύ0ΓΪ9minΡΎΒΡΤΫΨυΖ¥”ΠΥΌ¬ v(N2)ΘΫ________mol/(LΓΛmin)(±ΘΝτΝΫΈΜ”––ß ΐΉ÷)ΓΘ
ΔΎΒΎ12min ±ΗΡ±δΒΡΖ¥”ΠΧθΦΰΩ…ΡήΈΣ________(ΧνΉ÷ΡΗ¥ζΚ≈)ΓΘ
aΘ°≥δ»κΥ°’τΤχœΓ ΆΖ¥”ΠΈο bΘ°Φ”»κNO cΘ°Φ”¥ΏΜ·ΦΝ dΘ°‘ω¥σ―Ι«Ω
(3) “Έ¬œ¬Θ§―ΧΤχ÷–ΒΡSO2Ω…”ΟΡ≥≈®Ε»ΒΡNaOH»ή“ΚΈϋ ’ΒΟΒΫpH=7ΒΡ»ή“ΚΘ§ ‘ΦΤΥψΥυΒΟ»ή“Κ÷–![]() ΘΫ_____(“―÷Σ:≥ΘΈ¬œ¬H2SO3ΒΡΒγάκΤΫΚβ≥Θ ΐKa1=1.0ΓΝ10-2Θ§Ka2=6.0ΓΝ10-8)ΓΘ
ΘΫ_____(“―÷Σ:≥ΘΈ¬œ¬H2SO3ΒΡΒγάκΤΫΚβ≥Θ ΐKa1=1.0ΓΝ10-2Θ§Ka2=6.0ΓΝ10-8)ΓΘ
(4)―ΧΤχ÷–ΒΡSO2“≤Ω…”ΟNa2SO3»ή“ΚΈϋ ’Θ§Έϋ ’Ιΐ≥Χ÷–Θ§pHΥφn(SO32-):n(HSO3-)±δΜ·ΙΊœΒ»γœ¬±μΘΚ
n(SO32-):n(HSO3-) | 99ΘΚ1 | 1ΘΚ1 | 1ΘΚ99 |
pH | 8.2 | 7.2 | 6.2 |
Β±Έϋ ’“Κ≥ ÷––‘ ±Θ§»ή“Κ÷–άκΉ”≈®Ε»ΙΊœΒ’ΐ»ΖΒΡ «(―ΓΧνΉ÷ΡΗ): ___________
aΘ°c(NaΘΪ)=2c(SO32-)ΘΪc(HSO3-)
bΘ°c(NaΘΪ)>c(HSO3-)>c(SO32-)>c(HΘΪ)=c(OH-)
cΘ°c(NaΘΪ)+c(H+) =c(SO32-)+c(HSO3-)+c(OH-)