题目内容
19.质量相同的H2O和D2O与足量钠反应,放出的气体在标况下的体积之比为10:9.分析 根据n=$\frac{m}{M}$计算H2O和D2O的物质的量之比,发生反应2Na+2H2O=2NaOH+H2↑,2Na+2D2O=2NaOD+D2↑,根据方程式可知生成H2、D2的物质的量之比等于H2O和D2O的物质的量之比,相同体积气体体积之比等于其物质的量之比.
解答 解:质量相同的H2O和D2O的物质的量之比为$\frac{1}{18}$:$\frac{1}{20}$=10:9,由2Na+2H2O=2NaOH+H2↑、2Na+2D2O=2NaOD+D2↑,可知H2、D2的物质的量之比等于H2O和D2O的物质的量之比,即H2、D2的物质的量之比为10:9,相同体积气体体积之比等于其物质的量之比,故H2、D2的体积之比为10:9,
故答案为:10:9.
点评 本题考查化学方程式有关计算,比较基础,明确发生的反应即可解答,侧重对基础知识的理解巩固.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
7.下列表达式错误的是( )
| A. | 甲烷的电子式: | |
| B. | 氮原子的L层电子轨道表示式: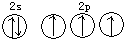 | |
| C. | 硫离子的核外电子排布式:1s22s22p63s23p4 | |
| D. | 碳-12原子:126C |
10.某硫酸厂拟用烟气处理含Cr2O72-的酸性废水,在脱硫的同时制备Cr2O3产品.具体流程如下:

已知吸收塔中反应后的铬元素以Cr3+形式存在,下列说法中正确的是( )

已知吸收塔中反应后的铬元素以Cr3+形式存在,下列说法中正确的是( )
| A. | 吸收塔中的硫元素可能以单质形式存在 | |
| B. | 中和池中只发生生成沉淀的复分解反应 | |
| C. | 在中和池中加入盐酸酸化的BaCl2溶液,可能产生白色沉淀 | |
| D. | 由题意分析得到,沉淀可能是Cr(OH)6 |
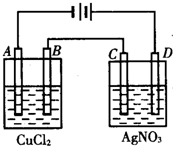 如图为以惰性电极进行电解:
如图为以惰性电极进行电解: 在某一容积为5L的密闭容器内,加入0.2mol的CO和0.2mol 的H2O(g),在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)═CO2(g)+H2(g),反应放出热量.反应中CO2的浓度随时间变化的情况如图所示:
在某一容积为5L的密闭容器内,加入0.2mol的CO和0.2mol 的H2O(g),在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)═CO2(g)+H2(g),反应放出热量.反应中CO2的浓度随时间变化的情况如图所示: 如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )