题目内容
15.在1mol/L的(NH4)2SO4溶液中,下列有关离子浓度大小比较中,正确的是( )| A. | c(NH4+)=2c(SO42-)>c(H+)=c(OH-) | B. | c(NH4+)>c(SO42-)>c(H+)>c(OH-) | ||
| C. | c(SO42-)>c(NH4+)>c(H+)>c(OH-) | D. | c(SO42-)>c(NH4+)>c(OH-)>c(H+) |
分析 硫酸铵属于强酸弱碱盐,铵根离子部分水解导致溶液呈酸性,则:c(H+)>c(OH-),再结合电荷守恒判断铵根离子和硫酸根离子浓度大小,注意铵根离子水解但程度较小.
解答 解:(NH4)2SO4是强酸弱碱盐,NH4+离子部分水解导致溶液呈酸性,则:c(H+)>c(OH-),再结合电荷守恒得:c(NH4+)>c(SO42-),由于NH4+的水解但程度较小,所以溶液中离子浓度大小顺序为:c(NH4+)>c(SO42-)>c(H+)>c(OH-),
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.人造地球卫星用到的一种高能电池--银锌蓄电池,其电极分别是Ag2O和Zn,电解液是KOH溶液.放电时,该电池的电极反应式为Zn+2OH--2e-=Zn(OH)2,Ag2O+H2O+2e-=2Ag+2OH-.下列说法中正确的是( )
①锌为负极,Ag2O为正极;
②放电时,正极附近溶液OH-浓度增大;
③工作时电流由Ag2O极经外电路流向Zn极;
④溶液中阴离子向正极方向移动,阳离子向负极方向移动.
①锌为负极,Ag2O为正极;
②放电时,正极附近溶液OH-浓度增大;
③工作时电流由Ag2O极经外电路流向Zn极;
④溶液中阴离子向正极方向移动,阳离子向负极方向移动.
| A. | 只有① | B. | 只有②③ | C. | 只有①③④ | D. | 只有①②③ |
6.下列各组有机物只用一种试剂无法鉴别的是( )
| A. | 乙醇、苯酚、硝基苯 | B. | 苯、乙醛、己烯 | ||
| C. | 甲酸、甲苯、乙酸 | D. | 苯乙烯、甲苯、环己烷 |
3.下列用系统命名法命名的有机物名称正确的是( )
| A. | 2-甲基-4-乙基戊烷 | B. | 3,4,4-三甲基己烷 | ||
| C. | 2,3-二甲基-1-戊烯 | D. | 1,2,4-三甲基-1-丁醇 |
20.共价键、离子键、分子间作用力都是微粒间的作用力,含有以上两种作用力的物质是( )
| A. | SiO2 | B. | Ar | C. | NaOH | D. | CO |
7.下列表达式错误的是( )
| A. | 甲烷的电子式: | |
| B. | 氮原子的L层电子轨道表示式: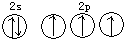 | |
| C. | 硫离子的核外电子排布式:1s22s22p63s23p4 | |
| D. | 碳-12原子:126C |
 如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )